Bienvenue dans la zone d'information de Dr. Galva
Tu trouveras ici les réponses aux questions les plus fréquentes sur notre offre de galvanisation. Que tu veuilles en savoir plus sur nos produits ou sur le processus de commande, tu trouveras des informations complètes sur cette page. Si tu as une question à laquelle tu ne trouves pas de réponse ici, n'hésite pas à nous contacter.
Vous trouverez le guide de galvanisation ici :
Si tu souhaites obtenir des informations sur les derniers développements ou d'autres publications, consulte également la section Publications : Publications
- Quelle est la différence entre le brunissage et la patine?
-
- Comment puis-je brunir le laiton pour le noircir ? Quel produit me recommandez-vous pour cela ?
-
Pour noircir le laiton, la patine est la meilleure option. Le Gel de patine Nero est spécialement conçu pour donner au laiton une surface sombre. Il est facile à appliquer et assure une patine décorative et durable.
En le diluant, il est également possible d'obtenir de très beaux tons bruns.
- En quoi les brunissages diffèrent-ils ?
-
Les brunissages de Dr. Galva se distinguent principalement par le type d'application et les utilisations spécifiques. Voici les principales différences entre les trois types :
1. Brunissage par immersion Ultra-3
- Application: Le brunissage par immersion est idéal pour le traitement de plusieurs pièces à la fois ou pour les formes complexes qui nécessitent un revêtement uniforme. Avec cette méthode, la pièce entière est immergée dans la solution de brunissage.
- Les avantages: Cette méthode permet d'obtenir un brunissage uniforme et continu, même dans les zones difficiles d'accès. Elle est particulièrement adaptée aux pièces de grande taille et aux applications industrielles.
- Domaines d'application: Optimal pour le brunissage de pièces en acier dans la production de masse ou dans les ateliers où de nombreuses pièces doivent être traitées en même temps.
2. Brunissage rapide Ultra-5
- Application: Ce brunissage universel est polyvalent et peut être utilisé par immersion ou par simple application. Il convient à une large gamme de matériaux et de pièces.
- Les avantages: Ce brunissage offre une flexibilité d'utilisation et constitue une excellente solution polyvalente pour différents projets. Elle est facile à utiliser et ne nécessite pas d'équipement spécial.
- Domaines d'application: Parfait pour les artisans et les bricoleurs qui recherchent une solution polyvalente pour différents types de brunissage, qu'il s'agisse de petites ou de grandes pièces.
3. Brunissage au pinceau Ultra-7
- Application: Le brunissage au pinceau consiste à appliquer la solution directement sur la surface de la pièce, par exemple avec un pinceau ou un chiffon. Cette méthode est particulièrement adaptée au traitement de petites surfaces ou aux retouches.
- Les avantages: Cette méthode permet une application précise et contrôlée, idéale pour les réparations ou pour les pièces qui ne peuvent pas être complètement immergées. Elle est rapide et facile à appliquer, même sur place.
- Domaines d'application: Convient pour les petits projets, les réparations ou pour rafraîchir les brunissages déjà existants. Elle est idéale pour les artisans qui souhaitent traiter des zones ciblées sans avoir à traiter la pièce entière.
Résumé :
- Brunissage par immersion: pour des revêtements réguliers et complets de plusieurs pièces ou de grandes pièces.
- Brunissage rapide: utilisation polyvalente, par immersion ou par application, pour différents matériaux.
- Brunissage au pinceau: application précise et facile pour les petites surfaces ou les retouches.
Chacun de ces types de brunissage de Dr. Galva offre des avantages spécifiques et est optimisé pour des domaines d'application particuliers, de sorte que tu peux choisir la bonne méthode pour chaque tâche.
Les brunissages de Dr. Galva sont spécialement conçus pour l'acier, le fer ou la fonte. Il existe aussi des brunissages adaptés aux alliages comme le cuivre ou le laiton - ce sont alors des patinages. - Quelle huile utiliser après le brunissage ?
-
Après le brunissage, il est recommandé d'utiliser une huile anticorrosion spéciale, conçue pour les surfaces brunies. Voici quelques options :
- Huiles spéciales de brunissage: ces huiles sont spécialement formulées pour sceller et protéger les surfaces brunies. Elles offrent une protection élevée contre la corrosion et préservent la surface noire.
- Huile pour armes: l'huile pour armes, telle qu'elle est utilisée pour l'entretien des armes à feu, est un bon choix. Elle est conçue pour protéger les surfaces métalliques contre la corrosion et convient donc parfaitement aux pièces brunies.
- Huile de lin: pour une protection naturelle, l'huile de lin convient également, elle forme une fine couche de protection tout en mettant en valeur le brunissage. Elle est cependant moins durable que les huiles spécialisées.
- Huile minérale: une huile minérale légère peut également être utilisée, surtout si aucune huile de brunissage spéciale n'est disponible. Elle offre une protection de base contre l'humidité, mais peut ne pas être aussi efficace que les produits plus spécifiques.
Il est important d'appliquer l'huile de manière régulière et fine pour garantir une couche de protection uniforme et d'essuyer l'excédent d'huile après quelques minutes pour que la surface ne reste pas collante.
- Comment sécher après le brunissage ?
-
Sèche les pièces directement après le brunissage avec un chiffon propre et non pelucheux, sinon de la corrosion peut se former.
Concernant le temps d'attente après le brunissage : Il est important que le brunissage soit complètement terminé et que la surface soit sèche avant de commencer à peindre. En général, un court temps d'attente d'environ 30 minutes à 1 heure est suffisant pour s'assurer que la surface est stable. Si l'humidité de l'air est élevée, il peut être utile d'attendre un peu plus longtemps ou de chauffer doucement les pièces pour accélérer le processus de séchage.
- Est-il nécessaire de huiler les choses brunies si elles sont ensuite peintes ?
-
L'huilage des pièces brunies sert principalement de protection supplémentaire contre la corrosion en scellant la surface et en la protégeant de l'humidité. Cependant, si tu souhaites ensuite peindre les tôles métalliques brunies avec un vernis transparent, l'huilage n'est pas nécessaire, car le vernis transparent se charge de la couche de protection.
De plus, la peinture n'adhérerait pas.
- Quelle est l'intensité de la protection anticorrosion d'un brunissage ?
-
La protection contre la corrosion d'un brunissage est limitée et n'offre généralement qu'une protection modérée contre la rouille. Le brunissage rapide crée une fine couche d'oxyde noir à la surface du métal, qui protège dans une certaine mesure contre la corrosion, mais qui n'est pas aussi efficace qu'un brunissage industriel plus épais ou qu'un revêtement.
Les facteurs qui influencent la protection contre la corrosion :
- Épaisseur de la couche: comme la couche d'oxyde créée par le brunissage est relativement fine, elle n'offre qu'une protection superficielle.
- Conditions environnementales: Dans les environnements humides ou agressifs, comme l'air salin, la protection offerte par un brunissage est souvent insuffisante et peut échouer assez rapidement si la surface n'est pas traitée en plus.
- Traitement ultérieur: la protection contre la corrosion peut être considérablement améliorée si la surface brunie est traitée après l'application avec une huile anticorrosion appropriée. Ce traitement ultérieur scelle la surface et la protège de l'humidité et d'autres influences corrosives.
Résumé :
Sans traitement ultérieur, le brunissage n'offre qu'une protection limitée contre la corrosion et convient principalement aux applications décoratives ou temporaires. Pour une protection à long terme, en particulier dans les environnements exigeants, un traitement ultérieur avec de l'huile ou un autre revêtement de protection est nécessaire.
- Anode en barre ou anode plate : laquelle choisir ?
-
Le choix entre une anode en barre ou une anode plate dépend de plusieurs facteurs :
1. Taille et forme de la pièce
- Anode plate : Idéale pour les grandes pièces ou lorsqu’on souhaite une épaisseur de dépôt uniforme sur une large surface. Parfaite pour la galvanoplastie en bain.
- Anode en barre : Mieux adaptée aux petites pièces ou lorsque le dépôt doit être appliqué sur des zones spécifiques. Parfaite pour la galvanoplastie au stylet.
2. Répartition du courant
- Anode plate : Assure une distribution de courant plus uniforme grâce à sa surface plus étendue, idéale pour des revêtements homogènes.
- Anode en barre : Peut entraîner des dépôts irréguliers, en particulier si la distance avec la cathode n’est pas constante. En galvanoplastie en bain, elle peut provoquer une densité de courant anodique trop élevée.
3. Disposition des électrodes
- Anode plate : Une configuration symétrique avec deux anodes plates opposées permet une déposition uniforme du métal.
- Anode en barre : Doit être placée de manière à maintenir une distance constante avec la pièce, afin d’éviter des différences d’épaisseur du dépôt. Le courant prend toujours le chemin le plus court !
4. Anode en barre pour la galvanoplastie au stylet
- Une anode en barre est principalement utilisée pour la galvanoplastie au stylet (ou tampographie électrochimique), car elle permet une application précise du revêtement.
- Idéale pour retoucher de petites zones ou pour des pièces qui ne peuvent pas être entièrement immergées dans un bain galvanique.
5. Anode plate pour la galvanoplastie en bain
- Les anodes plates sont particulièrement avantageuses pour la galvanoplastie en bain, car elles garantissent une déposition uniforme du métal sur les pièces de grande taille.
- Dans un bain de galvanoplastie, la pièce est entourée d’électrolyte sur plusieurs côtés, assurant un revêtement homogène.
- Deux anodes plates opposées garantissent une distribution symétrique du courant et améliorent considérablement la qualité du revêtement.
Conclusion
- Pour une épaisseur de revêtement uniforme et des grandes pièces → Anode plate, en particulier pour la galvanoplastie en bain.
- Pour des dépôts précis ou sur de petites surfaces → Anode en barre, en particulier pour la galvanoplastie au stylet.
- Toujours tenir compte des propriétés de l’électrolyte et de la répartition du courant !
- De quoi a-t-on besoin pour la galvanisation ?
-
1. Source d'alimentation
- Une alimentation CC réglable avec une tension et un courant appropriés pour l'électrolyte choisi.
2. Solution électrolytique
- Une solution électrolytique spécialisée contenant des ions métalliques (par exemple, électrolyte de cuivre pour le dépôt de cuivre, électrolyte de nickel pour le placage de nickel).
3. Anode (Pôle positif, +)
- Anode en cuivre pour le placage de cuivre
- Anode en nickel pour le placage de nickel
- Anode en zinc pour l'électrolyte de zinc
- Anode en aluminium pour l'électrolyte de chrome (alternativement anode en platine)
- Anode en acier inoxydable ou en platine pour les métaux précieux ou les électrolytes spéciaux
4. Cathode (Pôle négatif, -)
- La pièce à traiter qui doit être revêtue (par exemple, des pièces métalliques, des bijoux).
5. Récipient
- Un récipient en plastique ou un bac (résistant aux produits chimiques) pour le bain d'électrolyse.
6. Fils et pinces
- Pinces crocodile et câbles pour connecter les électrodes à la source d'alimentation.
7. Agents de prétraitement et post-traitement
- Produits de nettoyage et activateurs (par exemple, dégraissant, solutions de décapage – y compris le conditionneur).
- Passivation et agents de protection (par exemple, huile de brunissage) pour protéger le revêtement.
8. Équipement de sécurité
- Gants, lunettes de protection et éventuellement un masque respiratoire pour une manipulation sécurisée des produits chimiques.
- Quel set ou quelle alimentation devrais-je choisir ?
-
Tout d'abord, il faut déterminer l'objectif souhaité, c'est-à-dire la couche finale que l'on veut obtenir.
Les options disponibles sont le chrome, le cuivre, le nickel et le zinc.
Il existe également des combinaisons telles que cuivre/nickel, chrome/nickel et le grand kit.
Le kit pour le chrome est uniquement disponible en combinaison chrome/nickel, car il est généralement nécessaire de nickelé avant de chromer, le chrome étant ensuite déposé en fine couche.
Le cuivre sous le nickel est souvent avantageux, car il améliore considérablement la protection contre la corrosion, permet de compenser les irrégularités et facilite le polissage.
Le grand kit est idéal si l'on souhaite tout réaliser.
Bien sûr, chaque kit peut être utilisé différemment par la suite : il suffit d’ajouter les électrolytes et les anodes nécessaires pour déposer une autre couche.
Ensuite, il faut choisir l’alimentation nécessaire. Nous proposons un modèle compact avec une intensité maximale de 3A et un modèle plus puissant de 10A.
Le choix dépend de la taille des objets à traiter. Si l’on souhaite par la suite galvaniser des pièces plus grandes, il est préférable d’opter pour une alimentation puissante (10A). Plus tard, il suffira simplement d’acquérir des cuves plus grandes et de travailler avec les électrolytes appropriés.
En galvanoplastie, on travaille généralement avec la densité de courant, car chaque électrolyte possède une plage optimale spécifique. Celle-ci est exprimée en A/dm².
Pour calculer l’intensité de courant nécessaire, il faut multiplier la densité de courant recommandée pour l’électrolyte concerné par la surface de la pièce en dm². La tension s’ajuste automatiquement dès que l’intensité est réglée via la limitation de courant (la tension est automatiquement réduite jusqu’à atteindre l’intensité sélectionnée).
Dans ce tableau, tu peux lire la puissance nécessaire.
Électrolyte Courant de sortie 3A* 5A* 10A* Chrome 0,6 1 2 Cuivre acide 5 8,5 17 Cuivre alcalin 15 25 50 Nickel 10 17 34 Zinc 12 20 40 Zinc-nickel 3,3 5,5 11 * - Indications de la surface maximale à revêtir en dm² pour la densité de courant la plus faible possible
- Qu'est-ce que la galvanisation ?
-
La galvanisation, également connue sous le nom d'électrodéposition, est un processus électrochimique qui consiste à appliquer une fine couche de métal sur un autre matériau. Ce processus est souvent utilisé pour améliorer la surface d'un objet, pour le protéger contre la corrosion, pour augmenter sa résistance à l'usure ou pour améliorer son apparence.
Voici comment fonctionne la galvanisation :
-
Préparation de la pièce : la pièce qui doit être revêtue doit être soigneusement nettoyée pour éliminer les impuretés comme l'huile, la graisse ou la rouille. Ceci est essentiel pour l'adhérence de la couche métallique.
-
Bain électrolytique : la pièce est plongée dans un bain électrolytique contenant une solution d'ions métalliques qui doivent être déposés sur la pièce. La pièce est utilisée comme cathode (chargée négativement) et une anode métallique (chargée positivement) comme source d'ions métalliques.
-
Utilisation du courant électrique : un courant électrique est envoyé dans le bain d'électrolyte. Les ions métalliques chargés positivement se déplacent alors vers la cathode chargée négativement, où ils se déposent sous forme de couche métallique solide. L'épaisseur et la qualité de la couche métallique peuvent être contrôlées par l'intensité du courant, la composition de l'électrolyte et la durée du processus.
-
Finalisation : Après le processus de revêtement, la pièce est nettoyée et éventuellement polie pour obtenir la finition souhaitée.
Applications de la galvanisation :
- Protection contre la corrosion : des métaux comme le zinc ou le nickel sont appliqués sur l'acier pour empêcher la formation de rouille.
- Revêtement décoratif : les métaux précieux comme l'or ou l'argent sont appliqués sur les bijoux ou les objets décoratifs pour améliorer leur apparence.
- Protection contre l'usure : des métaux plus durs comme le chrome sont appliqués sur des outils ou des pièces de machine pour prolonger leur durée de vie.
- Applications électroniques : En électronique, de fines couches de métal sont appliquées sur les circuits imprimés ou les contacts afin d'améliorer la conductivité électrique.
La galvanisation est une technique très répandue dans l'industrie et l'artisanat et joue un rôle important dans de nombreux processus de production.
-
- Les procédés de galvanisation
-
Dans la section suivante, les différents procédés de galvanisation sont présentés, en expliquant également les outils de base nécessaires à chaque méthode. En général, on distingue trois procédés de galvanisation : la galvanisation en tonneau, la galvanisation au stylo/tampon et la galvanisation en bain.
Aperçu des procédés
On distingue trois procédés de dépôt galvanique des métaux : la galvanisation en bain, la galvanisation au stylo (ou galvanisation au tampon), et la galvanisation en tonneau. Chacun de ces procédés présente des avantages et des inconvénients.
Procédé Avantages Inconvénients galvanisation en bain - Déroulement automatique du processus de galvanisation
- Possibilité d'obtenir des épaisseurs de couche de quelques micromètres à plusieurs millimètres
- Bloc d'alimentation puissant nécessaire
- Grand réservoir nécessaire
- Grande quantité d'électrolyte
- Peu pratique pour la galvanisation de petites pièces
galvanisation au stylo/tampon - Possibilité de galvaniser de grandes surfaces
- Bloc d'alimentation de faible puissance nécessaire, car le courant ne circule qu'au petit point de contact
- Faible quantité d'électrolyte nécessaire
- Seules de faibles épaisseurs de couche peuvent être atteintes, donc peu de protection contre la corrosion
- Le processus de galvanisation n'est pas automatisé
- Prend beaucoup de temps
- Exigeant
galvanisation en tonneau - Convient parfaitement à la galvanisation de petites pièces
- Revêtement relativement uniforme grâce à la rotation continue
- Le processus de galvanisation se déroule automatiquement
- Remplissage rapide
- Bloc d'alimentation puissant nécessaire
- Grands réservoirs indispensables
- Grande quantité d'électrolyte
- Les pièces à usiner reçoivent de petites marques d'impact
- Un certain nombre de pièces est nécessaire pour que le contact avec les pièces soit permanent, ou taille de tambour appropriée
Le procédé de galvanisation en bain
La galvanisation en bain est une méthode dans laquelle la pièce à galvaniser et l'anode sont immergées dans un électrolyte. Un courant est appliqué, ce qui permet le dépôt de métal sur la pièce.
La galvanisation en bain est un procédé couramment utilisé dans l'industrie. En général, les pièces sont chromées, dorées ou nickelées dans de grands réservoirs. Des cadres sont souvent utilisés pour suspendre les pièces à revêtir. Pour augmenter la densité de courant possible et accélérer le dépôt, un mouvement du bain peut être appliqué, par injection d'air, pompage ou déplacement du cadre.
L'avantage de ce procédé est qu'il est facile à réaliser et permet de générer des courants élevés, rendant possible le dépôt de couches métalliques épaisses. L'inconvénient est qu'il nécessite de grandes quantités d'électrolyte pour remplir les réservoirs, ce qui rend la galvanisation en bain peu adaptée aux petits projets privés ou amateurs.
Équipement de base nécessaire
Pour réaliser le procédé de galvanisation en bain, une source de courant continu réglable, un réservoir ou un conteneur et des câbles de connexion sont nécessaires.
La source de courant peut être, par exemple, une alimentation de laboratoire, avec des affichages de tension (Volt) et de courant (Ampère). Le réservoir doit être suffisamment grand pour que l'objet à galvaniser puisse y être complètement immergé. Il doit être en matériau résistant aux alcalins et aux acides ; les conteneurs en plastique ou en verre sont particulièrement adaptés. En outre, vous aurez besoin de câbles pour connecter la source de courant à l'anode et à la pièce. Pour éviter toute confusion, utilisez toujours un câble rouge pour le pôle (+) et un câble noir pour le pôle (-).
Surface de l'anode
En règle générale, la surface de l'anode doit correspondre à la taille de la surface de la pièce à galvaniser. Si la surface de l'anode est trop petite, il est possible que les couches se déposent de manière inégale.
Cet effet se produit parce que le courant ne se distribue pas uniformément dans l'électrolyte (diffusion) et suit le chemin le plus court. Dans la zone où le chemin est le plus court, le courant est plus fort, ce qui entraîne un dépôt plus épais à cet endroit. La forme et la disposition de l'anode doivent également permettre une répartition uniforme du courant.
Une anode plus grande n'a pas d'effet négatif sur le résultat. Cependant, une densité de courant anodique inadéquate (rendement anodique) peut entraîner une passivation plus importante (selon l'électrolyte), réduisant ainsi le flux de courant. Si cela se produit, l'anode doit être nettoyée.
Le procédé de galvanisation au stylo ou au tampon
Lorsque des pièces de grande taille ou déjà montées doivent être galvanisées, la galvanisation au stylo est la plus adaptée. Ce procédé utilise une tige métallique connectée à l'anode (+), dont l'extrémité est équipée d'un tampon en tissu ou d'une éponge (pour simplifier, nous utiliserons le mot "tampon"). Le tampon sert à absorber l'électrolyte et doit être entièrement imbibé de la solution souhaitée. Pendant que l'objet à galvaniser est connecté à la cathode (-), le tampon est appliqué sur l'objet en effectuant un mouvement circulaire. Cela permet de créer un flux de courant et, en quelques secondes, une couche métallique se dépose sur les points de contact.
Le mouvement circulaire est crucial, car une petite surface de contact entraîne un courant élevé. Si le tampon reste trop longtemps au même endroit, cette zone peut devenir mate et prendre une couleur foncée (brûlure), cet effet s'accélérant à mesure que le courant augmente. Il faut donc un peu d'expérience, mais cela s'acquiert rapidement. Un mouvement de va-et-vient du tampon est moins approprié, car les interruptions momentanées peuvent provoquer des brûlures à haute densité de courant.
L'anode doit être fabriquée à partir de matériaux inertes tels que le platine, le graphite (ou dans certains cas, l'acier inoxydable), ou du même matériau que celui de l'électrolyte utilisé.
Équipement de base nécessaire
Pour réaliser le procédé de galvanisation au stylo ou au tampon, il vous faut une source de courant continu réglable (une alimentation avec affichage numérique de la tension et du courant), une anode en forme de stylo avec support d'anode (stylo de galvanisation), un jeu de câbles et un tampon ou une éponge. L'anode du stylo (ou son support) doit être connectée au pôle (+) de l'alimentation à l'aide d'un câble. De plus, l'anode doit être équipée d'un tampon ou d'une éponge pour que le stylo de galvanisation soit prêt à l'emploi. La pièce elle-même est connectée au pôle (-), comme dans les autres procédés mentionnés.
Tampons et éponges
Les tampons ou éponges utilisés servent à absorber l'électrolyte. Cette caractéristique est essentielle, car l'électrolyte doit être maintenu entre l'anode et la pièce à galvaniser pendant le processus, afin que les ions métalliques puissent être transférés. Les tampons utilisés pour la galvanisation doivent avoir une très grande capacité d'absorption et être résistants. Ils ne doivent pas être trop fins, sinon des effets d'isolation pourraient se produire en raison de la pression exercée par endroits, empêchant le passage du courant électrique. De plus, un tampon ne doit pas comporter de coutures apparentes, car celles-ci pourraient rayer la surface du métal.
Épaississant ou agent gélifiant
Un épaississant, ou agent gélifiant, est une substance spécifique ajoutée à l'électrolyte pour en augmenter la viscosité. Il existe des épaississants spécialement conçus pour différents types d'électrolytes. L'utilisation de produits non adaptés rendrait l'électrolyte inutilisable. Grâce à ces agents gélifiants, il est possible d'épaissir tous les types d'électrolytes, garantissant ainsi un travail propre et économique, sans écoulements. Toutefois, l'électrolyte ne doit pas être trop épais.
Pour épaissir un électrolyte, il suffit de verser la quantité nécessaire dans un récipient et d'ajouter progressivement l'agent gélifiant en remuant jusqu'à obtention de la consistance souhaitée. Il est important d'agir avec précaution pour éviter la formation de poussières lors de l'utilisation de poudres épaississantes. Si l'électrolyte devient trop épais, il peut être dilué en ajoutant plus d'électrolyte non épaissi.
Le procédé de galvanisation en tonneau
La galvanisation en tonneau est idéale pour le traitement de grandes quantités de petites pièces, en particulier pour celles qui ne peuvent pas être fixées sur des supports ou qui demandent trop d'efforts pour y être attachées. En principe, le processus de galvanisation est similaire à celui de la galvanisation en bain, mais les pièces à traiter sont placées en vrac dans un tonneau rotatif à faible vitesse. Le contact avec les pièces est assuré par une tige de contact centrale, des marteaux mobiles (câbles avec des embouts conducteurs) ou des points de contact appropriés sur la paroi du tonneau. La rotation de ce dernier, assurée par un moteur, garantit un mouvement constant qui permet un revêtement relativement uniforme des petites pièces. Cependant, il peut y avoir de légères différences, car le brassage non contrôlé fait que certaines pièces sont en contact plus longtemps, obtenant ainsi une couche plus épaisse, ou, à l'inverse, un contact plus court et donc une épaisseur moindre.
Un avantage de ce procédé est la rapidité de chargement, car les pièces peuvent être déposées en vrac dans le tonneau. En revanche, les pièces présentent toujours de petites marques d'impact dues au mélange constant, ce qui rend ce procédé moins adapté aux finitions miroir, bien que cela n'ait pas d'importance pour des pièces comme les vis. De plus, un minimum de pièces est nécessaire pour garantir un contact permanent entre elles.
Équipement nécessaire
Pour réaliser la galvanisation en tonneau, vous aurez besoin d'un tonneau de galvanisation. En plus du tonneau, un moteur réducteur et la mécanique constituent les éléments essentiels, formant ainsi une installation de galvanisation en tonneau. Comme pour la galvanisation en bain, un bloc d'alimentation suffisamment puissant et réglable ainsi qu'un jeu de câbles sont également nécessaires.
Remplissage du tonneau de galvanisation
En général, le tonneau de galvanisation ne doit être rempli qu'à 40 ou 50 % de sa capacité avec les pièces à traiter. Cela garantit que les pièces peuvent bouger librement et empêche tout coincement, blocage ou accrochage. Si cela se produit, les points de contact ne seront pas optimaux, ce qui entraînera une galvanisation irrégulière. Il est essentiel de veiller à ce que les pièces aient également un bon contact avec la tige de contact.
Remarque : Les billes sont le matériau de remplissage idéal, car elles ne peuvent pas s'accrocher et permettent un mouvement libre, garantissant ainsi un résultat optimal de galvanisation.
- Déroulement automatique du processus de galvanisation
- Comment le voltage et la densité de courant affectent-ils le processus ?
-
En galvanisation, le voltage et la densité de courant jouent un rôle crucial dans la qualité de la couche déposée. Ces deux paramètres doivent être ajustés avec soin pour obtenir un revêtement métallique uniforme et de haute qualité.
1. Voltage :
- Fonction : Le voltage (mesuré en volts) permet au courant électrique de circuler à travers l'électrolyte, transportant les ions métalliques de l'anode vers la cathode (la pièce à revêtir), où ils se déposent sous forme de couche métallique.
- Influence : Une tension trop élevée peut entraîner une déposition trop rapide des ions métalliques, créant une couche rugueuse, poreuse ou même poudreuse. À l'inverse, une tension trop faible ralentit le processus de dépôt, réduisant ainsi l'efficacité et entraînant un revêtement irrégulier.
- Dépendance à la distance : La tension doit être ajustée en fonction de la distance entre l'anode et la cathode, car la résistance électrique de l'électrolyte augmente avec la distance. Plus l'anode est éloignée de la cathode, plus le voltage doit être élevé pour atteindre une densité de courant suffisante. Les valeurs de tension indiquées pour nos électrolytes sont des valeurs indicatives, basées sur une distance d'environ 10 cm. Si cette distance varie, la tension doit être ajustée en conséquence.
- Valeurs maximales : Notez que les valeurs maximales de tension spécifiées ne peuvent souvent être atteintes que dans des conditions idéales, comme lorsque le bain est en mouvement (par exemple, par agitation ou pompage), ce qui permet à l'électrolyte de circuler uniformément autour de la pièce et d'éviter les points chauds ou les dépôts irréguliers.
2. Densité de courant :
- Définition : La densité de courant correspond à la quantité de courant par unité de surface de l'électrode, exprimée en ampères par décimètre carré (A/dm²). Elle décrit la relation entre le courant électrique et la surface de l'électrode et est un facteur clé dans la qualité du dépôt de métal.
- Influence sur la cathode (pièce à revêtir) : La densité de courant cathodique influence fortement la qualité du revêtement sur la pièce (cathode). Chaque électrolyte a une plage optimale de densité de courant dans laquelle le dépôt se fait avec de bons résultats. Une densité de courant trop élevée peut entraîner des couches rugueuses et grossières, tandis qu'une densité trop faible peut provoquer des revêtements insuffisants ou irréguliers.
- Influence sur l'anode : La densité de courant anodique est essentielle pour la stabilité de l'électrolyte. Idéalement, le métal de l'anode (généralement le même métal que celui déposé) devrait se dissoudre à la même vitesse qu'il se dépose sur la cathode. Cela garantit une concentration uniforme d'ions métalliques dans l'électrolyte et contribue à la durabilité du bain. En pratique, il y a souvent des écarts, ce qui peut affecter la stabilité de l'électrolyte et l'efficacité du processus.
- Ajustement par la température et le mouvement : Des densités de courant plus élevées peuvent être appliquées en augmentant la température et en déplaçant l'électrolyte ou la pièce. Ces mesures améliorent le transport des ions et permettent un dépôt plus uniforme et efficace.
- Dépendance à la forme de la pièce et de l'anode : La densité de courant varie également en fonction de la forme de la pièce et de l'anode. Le courant ayant tendance à emprunter le chemin le plus court, une répartition inégale du courant peut entraîner des revêtements irréguliers, notamment sur les angles, les bords ou les géométries complexes. Un ajustement soigneux de l'anode à la forme de la pièce, ainsi que l'utilisation d'électrodes auxiliaires, peut aider à corriger ce problème.
- Optimisation : Un ajustement précis de l'anode à la forme de la pièce, ainsi que l'utilisation d'électrodes auxiliaires, peut aider à obtenir une distribution uniforme du courant et garantir ainsi un revêtement homogène.
Interactions entre le voltage et la densité de courant :
- Le voltage et la densité de courant sont liés : une tension plus élevée entraîne généralement une densité de courant plus élevée, tant que les résistances du système (comme la résistance de l'électrolyte et l'état de surface) restent constantes.
- Il est souvent nécessaire d'ajuster la tension pour atteindre la densité de courant souhaitée, mais d'autres facteurs tels que la concentration de l'électrolyte et la température influencent également cette relation.
Résumé :
- Le voltage alimente le processus et influence la vitesse de dépôt du métal. Il doit être ajusté avec soin, en particulier en tenant compte de la distance entre l'anode et la cathode, pour garantir un revêtement uniforme.
-
La densité de courant détermine la quantité de métal déposée par unité de surface et affecte la qualité et l'apparence du revêtement. Elle doit être réglée avec soin dans la plage optimale pour obtenir un revêtement de haute qualité.
- La densité de courant cathodique et la densité de courant anodique jouent toutes deux un rôle crucial : la densité cathodique affecte la qualité du revêtement, tandis que la densité anodique garantit la stabilité de l'électrolyte. La gestion de la température et du mouvement dans le bain peut aider à appliquer des densités de courant plus élevées et à améliorer la stabilité du processus.
- Caractéristiques des différentes couches
-
Chacune des couches appliquées offre certaines caractéristiques qui, au final, ont un effet positif sur la qualité du résultat final. Bien que le revêtement de cuivre ne soit pas obligatoire pour de nombreux matériaux, il permet d'obtenir un résultat de meilleure qualité.
Le cuivre se dépose rapidement et permet d'obtenir une surface particulièrement lisse. De plus, il se polit très bien, ce qui réduit sensiblement les coûts de polissage. Le nickel augmente la résistance à la corrosion de l'ensemble du revêtement. Lors d'un chromage ultérieur, il contribue de manière déterminante à la brillance de la couche de chrome.
La dernière couche, appliquée en fine couche, constitue la finition et présente l'utilité décorative ou technique souhaitée.
- Protection des couches contre la corrosion
-
Une bonne protection contre la corrosion n'est obtenue qu'avec une couche suffisamment épaisse ou alors avec une combinaison de couches appropriée. Une fine couche de chrome sur du fer n'offre pratiquement aucune protection, c'est pourquoi on utilise au moins la combinaison nickel-chrome. La couche de nickel sous-jacente présente un autre avantage, car le nickel (nickel brillant) fait mieux ressortir le brillant. Si l'on souhaite également améliorer la protection contre la corrosion dans une atmosphère réductrice, on utilise la combinaison de couches cuivre-nickel-chrome, car le cuivre fait ici un meilleur travail.
La règle générale est donc la suivante :
La protection contre la corrosion est très différente en fonction du métal formé. Il existe également de grandes différences entre les différents types d'électrolytes. De nombreux types déposent avec des pores microscopiques - dans ces zones, la protection est inexistante. Pour fermer les pores, des couches plus épaisses sont nécessaires. Une combinaison de plusieurs couches améliore nettement la protection. Les différentes couches se complètent alors et la protection contre la corrosion augmente de manière exponentielle, conformément à la devise "1+1=5".
Exemples de protection contre la corrosion
Nickel :
Une couche de nickel pur ne possède une bonne protection contre la corrosion qu'à partir de 25 µm, mais la protection est fortement améliorée dans la combinaison de couches nickel-chrome ou cuivre-nickel-chrome.
Zinc :
Pour le zinc, une épaisseur de couche d'environ 10µm est recommandée. Le zinc a un effet à distance qui permet de protéger cathodiquement les zones de fer non recouvertes (p. ex. les pores ou les zones endommagées mécaniquement).
Zinc-nickel :
Ici, la combinaison de deux éléments de protection se rencontre. D'une part, le zinc actif et le nickel passif. Les deux éléments forment une couche commune offrant une protection accrue. L'épaisseur moyenne des couches se situe entre 5 µm et 10 µm. Les couches sont également résistantes à la corrosion à des températures allant jusqu'à 180°C, ce qui fait que les couches de zinc-nickel sont idéales pour protéger les composants des moteurs à combustion.
Ici, dans l'exemple, un châssis chromé, avec une épaisseur de couche manifestement insuffisante, ou une exécution inadaptée de la couche de base :

- Ordre de revêtement
-
Le revêtement d'une pièce se fait généralement en plusieurs étapes, au cours desquelles différentes couches sont déposées sur la surface de l'objet. Chacune de ces couches possède des propriétés importantes pour obtenir un résultat professionnel.
En fonction du matériau et de l'état de la surface, un traitement préalable est nécessaire. Par exemple, les matériaux sensibles aux acides comme le zinc nécessitent une couche appliquée avec un Cuivre électrolyte alcalin avant d'être recouverts d'un Cuivre électrolyte acide. L'aluminium est prétraité avec un activateur d'aluminium et le cuivre nécessite une fine couche de palladium avant l'application sans courant de la couche de nickel.
Structure pratique de l'ordre des couches après le prétraitement :
- cuivre brillant pour un bon nivellement
- Nickel comme couche de barrière de diffusion
- Or, argent ou chrome comme couche finale
En général, la dernière couche est appliquée en couche mince.
- La dispersion en galvanisation
-
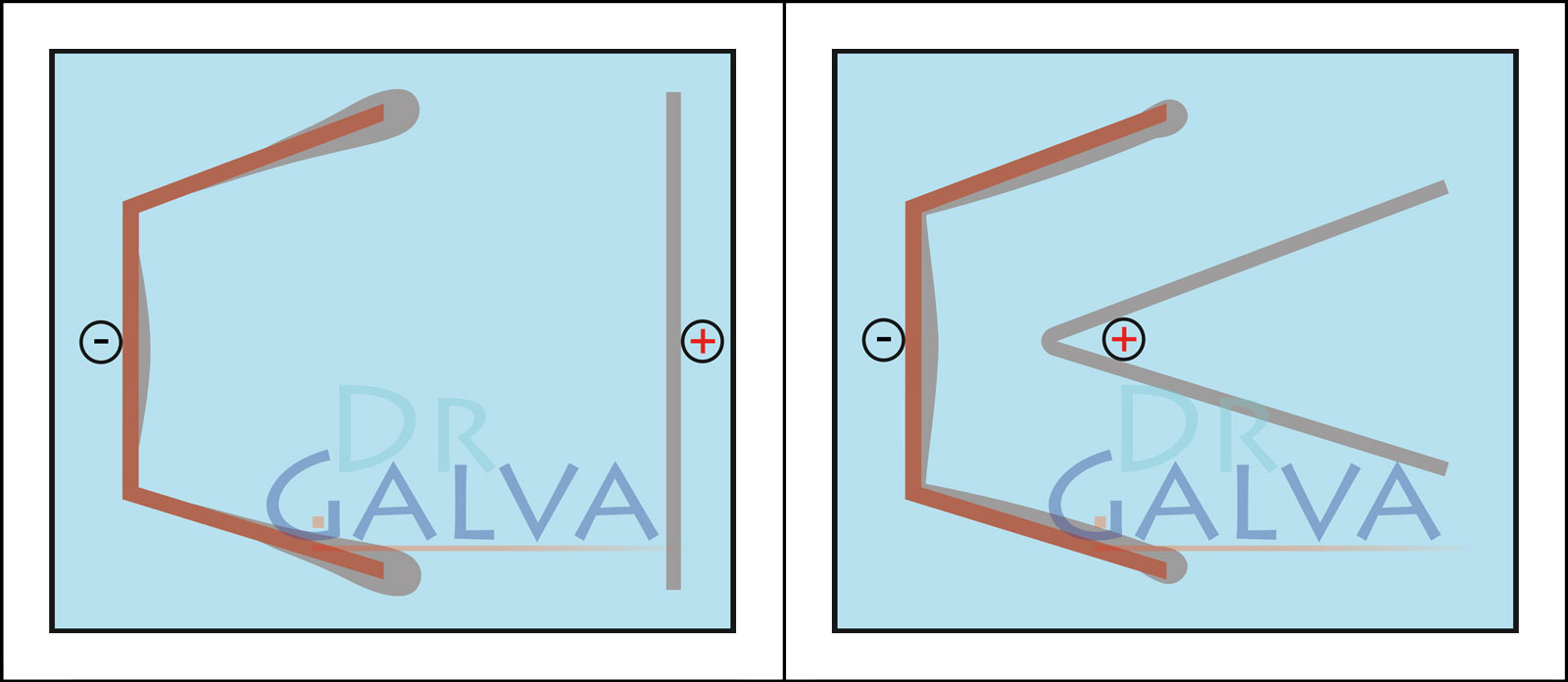
Nous abordons ici la question très importante de la diffusion à prendre en compte. L'anode doit être adaptée à la forme de la pièce à revêtir. Un flux de courant plus important à lui seul assombrirait et ternirait les endroits les plus proches de l'anode, car la densité de courant serait alors trop élevée localement.
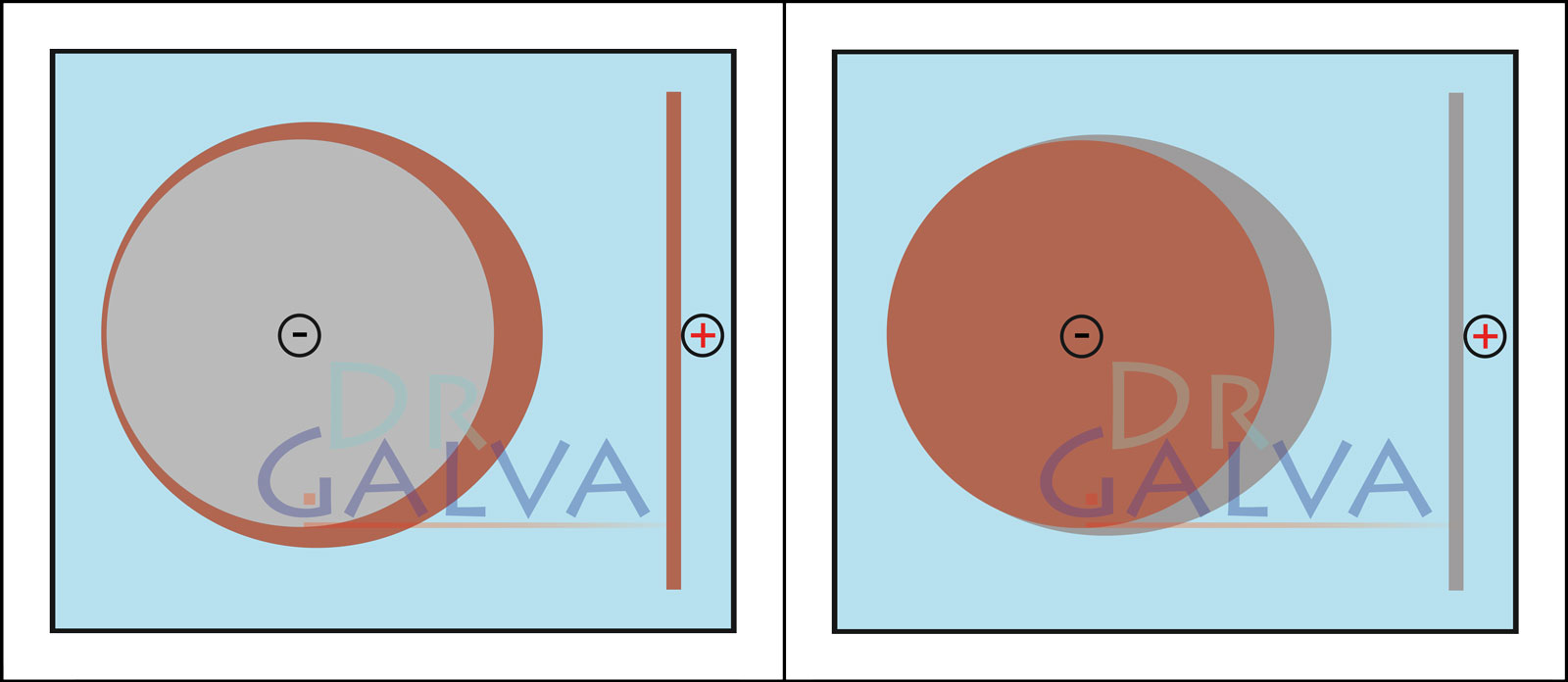
Bonne diffusion (par ex. cuivre acide) en utilisant une anode plate. Plus la distance est faible, plus le courant passe à ces endroits et plus de métal y est déposé. Grâce à la bonne diffusion, une fine couche est tout de même déposée sur la face arrière. Mauvaise diffusion (par ex. zinc faiblement acide). Dans ce cas, le métal n'est déposé que sur la face orientée vers l'anode. Sur la face arrière, le courant ne circule pratiquement pas et il n'y a pas de dépôt ou seulement un dépôt minimal. 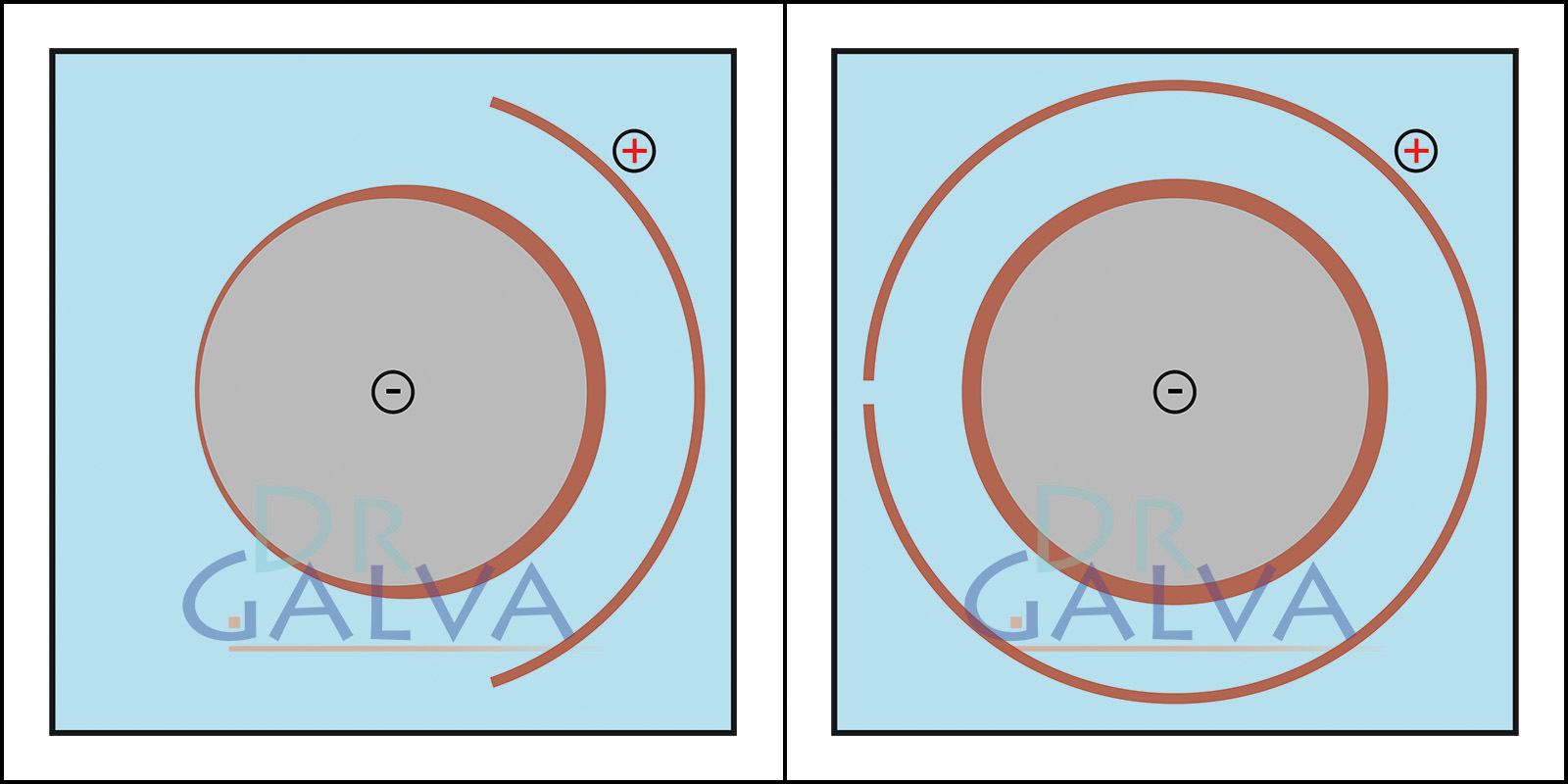
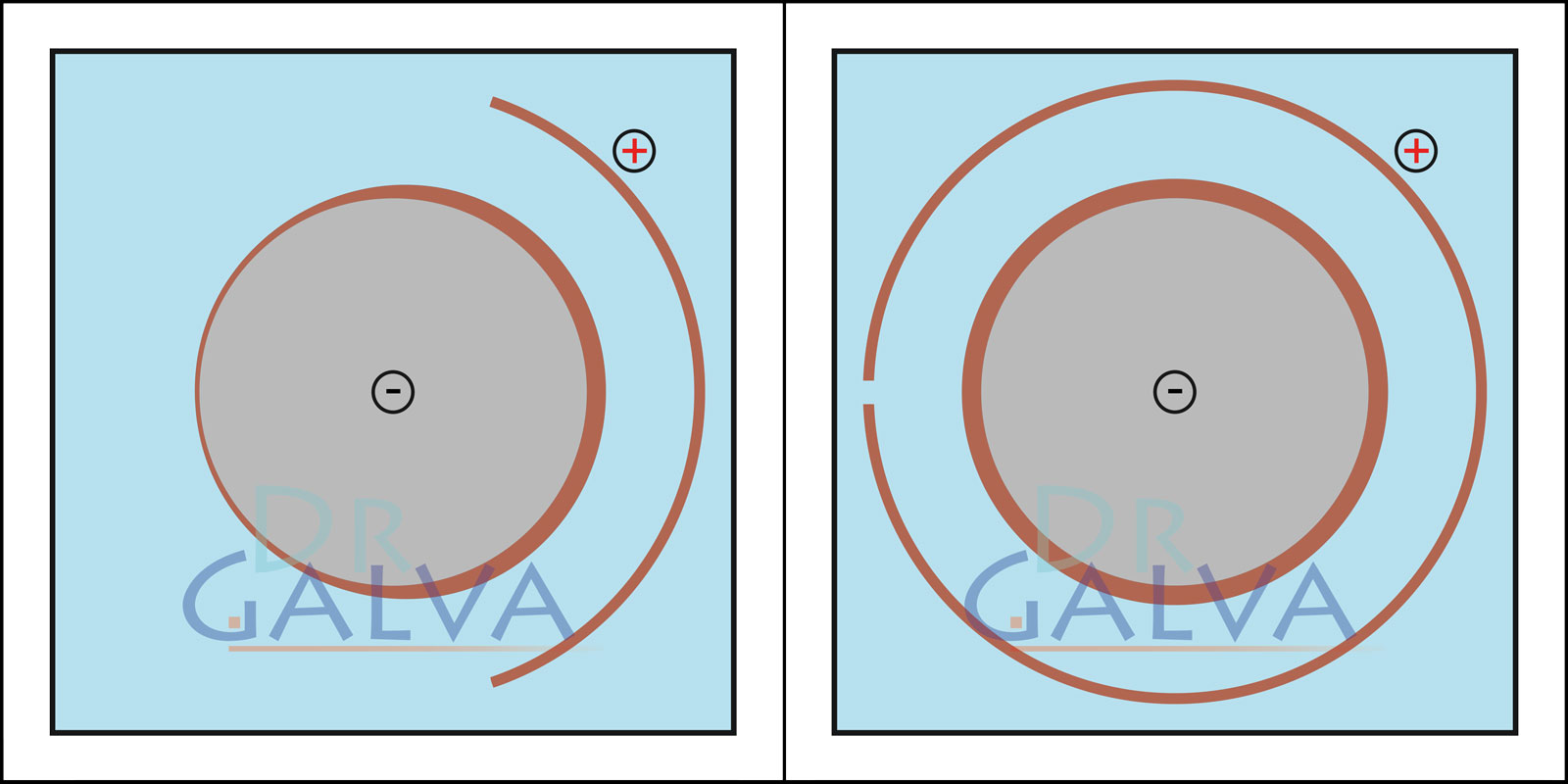
Si la forme est adaptée à la pièce, le métal se dépose de manière nettement plus régulière. Sur la face opposée à l'anode, la couche est plus fine. Globalement, la couche devient nettement plus uniforme par rapport à une anode plate. Dans le bain galvanique, on trouve une anode annulaire et la pièce à usiner. De cette manière, on s'assure que la distance entre l'anode et la pièce à usiner est la même tout autour. Pour obtenir un dépôt uniforme, il n'est pas nécessaire de faire tourner la pièce. 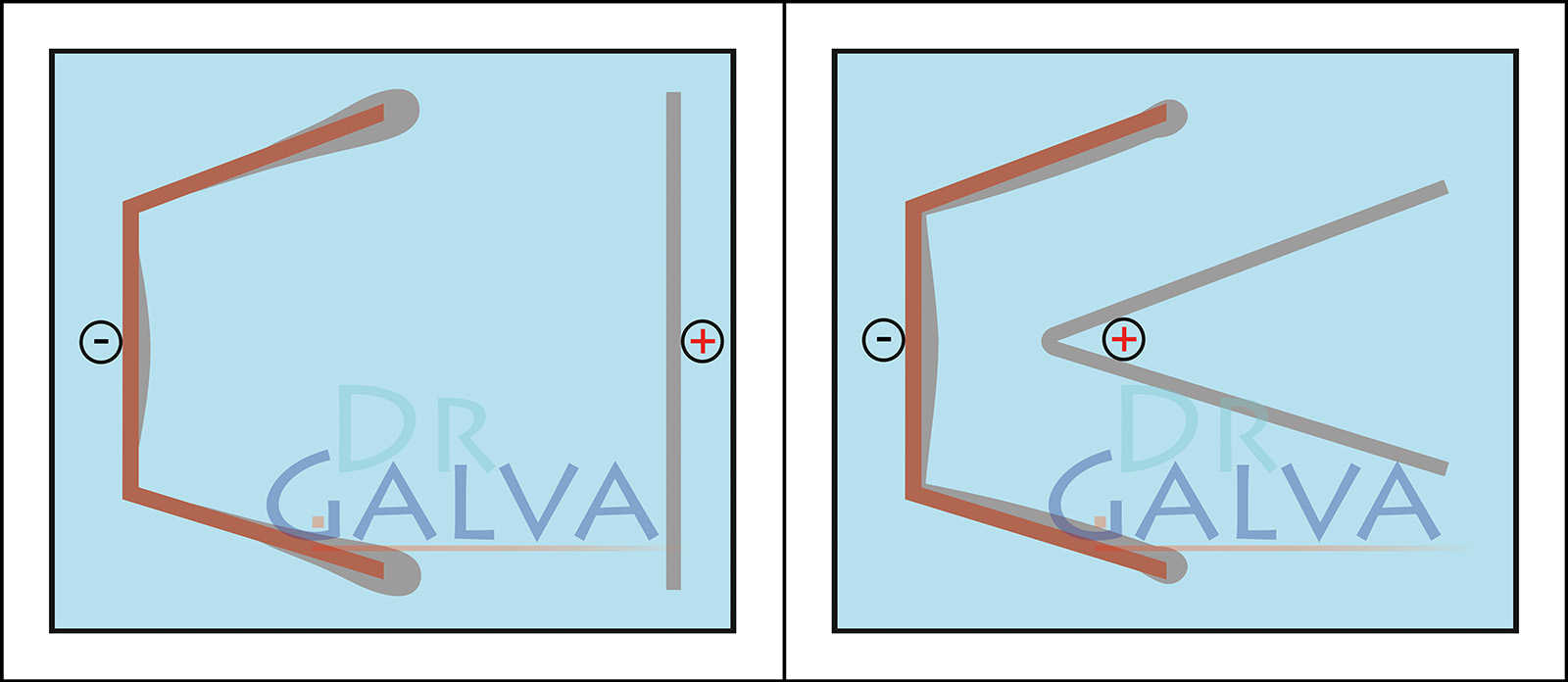
C'est la forme la plus compliquée, le métal se dépose presque uniquement dans la zone faisant face à l'anode. Avec une anode adaptée à la forme, on obtient encore un bon dépôt à l'intérieur, même les coins sont revêtus. Toutefois, cette opération est assez coûteuse. - Pourquoi la teneur en métal est-elle relativement peu importante ?
-
La teneur en ions métalliques (p. ex., Cu²⁺, Ni²⁺, Zn²⁺) est sans conteste un paramètre de contrôle important d’un électrolyte de galvanoplastie – mais ce n’est qu’un parmi beaucoup d’autres et, en pratique, ce n’est presque jamais le facteur limitant pour la qualité du dépôt, l’économie ou la stabilité du procédé. Les principales raisons :
Pourquoi ce n’est pas “le plus important” Ce qui compte (au moins) tout autant 1. Influence limitée au-delà d’un minimum
Même à des concentrations modérées, l’alimentation ionique à la cathode est saturée. Des teneurs métalliques plus élevées n’apportent qu’un faible gain de densité de courant, mais augmentent la densité, la viscosité et la formation de boues.Densité de courant & répartition
Plus de 90 % des défauts de dépôt (brûlures, taches, pores) dépendent de la densité de courant locale – pilotée par la géométrie, l’écartement, l’agitation et les anodes auxiliaires, non par la teneur métallique.2. La structure cristalline est gouvernée par les additifs
Brillance, taille de grain, contraintes internes et ductilité résultent de teneurs en ppm de porteurs, brillantants et niveleurs organiques … totalement indépendantes du fait que le bain contienne 20 g L⁻¹ ou 30 g L⁻¹ de Ni²⁺.Chimie des additifs & produits de dégradation
Le rapport porteur/brillantant modifie le dépôt bien davantage que ±20 % de Ni²⁺. Les listes analytiques suivent généralement > 10 paramètres organiques mais un seul paramètre métallique.3. La conductivité provient surtout de la matrice saline
Les pertes ohmiques sont déterminées principalement par les ions sulfate, chlorure ou fluoborate. Un bain d’argent ne contient que 2–3 g L⁻¹ d’Ag⁺, mais atteint une forte conductivité grâce à 150 g L⁻¹ de KCN.Ions de conductivité & pH
Le pH régit l’évolution d’hydrogène, la brillance et les contraintes; les systèmes tampons (acide borique, citrate) stabilisent l’électrolyte et le dépôt.4. Thermodynamique vs cinétique
La teneur métallique modifie à peine ΔG; la cinétique de dépôt est dominée par la température, la vitesse d’agitation et la complexation (EDTA, tartrate …).Température & hydrodynamique
Une variation de ±5 K influence souvent davantage la répartition d’épaisseur que ±20 % de métal.5. Longévité du bain & postes de coût
Dans les bains Cu et Ni, le coût des ions métalliques représente < 20 % du coût total par m² de dépôt; la recharge des additifs, l’énergie, le nettoyage, les effluents & l’analyse coûtent davantage.Gestion des contaminations
Des traces de Cu dans des bains Ni ou la dégradation du saccharinate peuvent ruiner un bain, même si la teneur métallique est “idéale”.6. La teneur métallique ne définit pas la “durée de campagne”
Dans des électrolytes autorégénérants, la dissolution anodique remplace en continu le métal déposé. La durée de campagne d’un bain est donc limitée par la dégradation des additifs, l’apport d’impuretés et la perte de volume – pas par la teneur métallique initiale.Matériau d’anode & mécanismes de dissolution
La pureté de l’anode, la teneur en chlorures (dans les bains Cu-OP) et la fenêtre de densité de courant appropriée déterminent l’efficacité de la redissolution de Cu, Ni, Zn, etc. Un bain bien piloté maintient son niveau de métal constant pendant des mois, tandis que les additifs organiques doivent être réapprovisionnés régulièrement.Conclusion : La teneur en ions métalliques n’est que le socle du procédé de galvanoplastie. Pour la qualité du dépôt, la stabilité et l’économie, la gestion de la densité de courant, les additifs, l’hydrodynamique, la maîtrise de la température, la dissolution anodique et les contaminations sont bien plus déterminantes.
- Anodes solubles - avantages, pratique, limites
-
Les anodes solubles sont constituées du métal à déposer et se dissolvent sous courant. Elles reconstituent ainsi les ions métalliques dans l’électrolyte proportionnellement au courant - la composition du bain reste plus stable sans ajout constant de sels métalliques.
Avantages des anodes solubles
- Auto-approvisionnement en ions métalliques : Dissolution de l’anode ≈ dépôt métallique → moins de redosage en sels métalliques.
- Pas de « sursalage » anionique : Au lieu d’introduire sulfate/chlorure à chaque appoint, seul le métal entre dans le bain → variations moindres de conductivité et de volume, moins de corrections.
- Conditions pH/redox plus stables : L’oxydation se fait par dissolution du métal, et non par l’eau/le chlorure → moins de dégagement d’O₂/Cl₂, oxydation des additifs réduite.
- Tension de cellule plus faible, meilleure efficacité énergétique : La dissolution du métal requiert en général des potentiels d’anode inférieurs à l’évolution d’oxygène.
- Qualité de dépôt plus constante : Une activité métallique plus homogène favorise un brillant uniforme, l’affinage du grain et la vitesse de dépôt.
- Pratique en atelier : Moins de manipulation de produits chimiques, moins d’arrêts grâce à des intervalles d’appoint plus longs.
Pratique typique
- Nickel : Anodes Ni activées au soufre / pastilles de Ni en panier Ti + un peu de chlorure pour éviter la passivation.
- Cuivre (acide) : Anodes de Cu phosphorées (contenant du P) + poches d’anode pour retenir les boues.
- Étain, zinc, etc. : Largement utilisés avec des anodes solubles.
Limites / inconvénients
- Boues d’anode & passivation → poches d’anode, filtration, densité de courant d’anode appropriée.
- Impuretés métalliques susceptibles de se dissoudre conjointement (qualité des anodes essentielle).
-
Pas toujours adapté :
- Bains de chrome(VI) fonctionnent avec des anodes insolubles (pas d’augmentation des ions métalliques ; électrochimie différente recherchée).
- Bains de chrome(III) : L’utilisation d’anodes métalliques de chrome peut générer du Cr(VI) et endommager l’électrolyte ; en outre, le Cr(III) s’appauvrit par le dépôt, limitant la durée de vie du bain.
- Pourquoi Raviveur de brillance si les anodes enrichissent déjà le bain ?
-
En bref : Les anodes fournissent (presque uniquement) des ions métalliques - la brillance provient d’additifs organiques. Ces additifs ne sont pas générés à l’anode et sont continuellement consommés ou dégradés en service. Le bain a donc besoin d’un brillantant d’appoint régulier.
Pourquoi l’enrichissement par les anodes ne suffit pas
- Les anodes dissolvent le métal (p. ex. Ni²⁺, Cu²⁺) et maintiennent ainsi la concentration métallique. Les additifs organiques (carrier/suppressor, brightener/accelerator, leveler) sont ajoutés de l’extérieur - pas produits par l’anode.
- Consommation à la cathode : Les additifs s’adsorbent à la surface ; certains se co-déposent ou sont réduits/décomposés électrochimiquement. Cela dépend de la densité de courant et des ampères-heures traités.
- Dégradation à l’anode : Une partie des composants organiques y est oxydée (notamment dans les bains chlorurés ou à forte polarisation anodique).
- Pertes annexes : entraînement sur pièces/porteurs, adsorption dans le filtre/sac d’anode, dégradation thermique/chimique ainsi que purification (p. ex. au charbon actif) retirent des additifs du bain.
Rôle du brillantant d’appoint
- Il contient généralement les composants à courte durée de vie, très actifs (souvent la fraction « accélérateur/brillantant »), consommés le plus rapidement.
- Sans réappoint, le dépôt perd brillance, nivellement et grain fin ; des zones mates, des contraintes accrues ou de la rugosité peuvent apparaître.
Conclusion
L’anode compense le métal, le brillantant d’appoint compense les additifs organiques fonctionnels - les deux sont nécessaires pour des dépôts réguliers et brillants.
Remarque sur la durée de vie du bain
Théoriquement, dans des électrolytes régénérables, la dissolution des anodes pourrait permettre un fonctionnement illimité, mais d’autres additifs sont consommés. Pour continuer à utiliser l’électrolyte coûteux, on complète ces additifs. Sans procédés de nettoyage spécifiques, l’électrolyte ne dure toutefois pas indéfiniment - avec un entretien approprié des additifs, sa durée de service peut être multipliée.
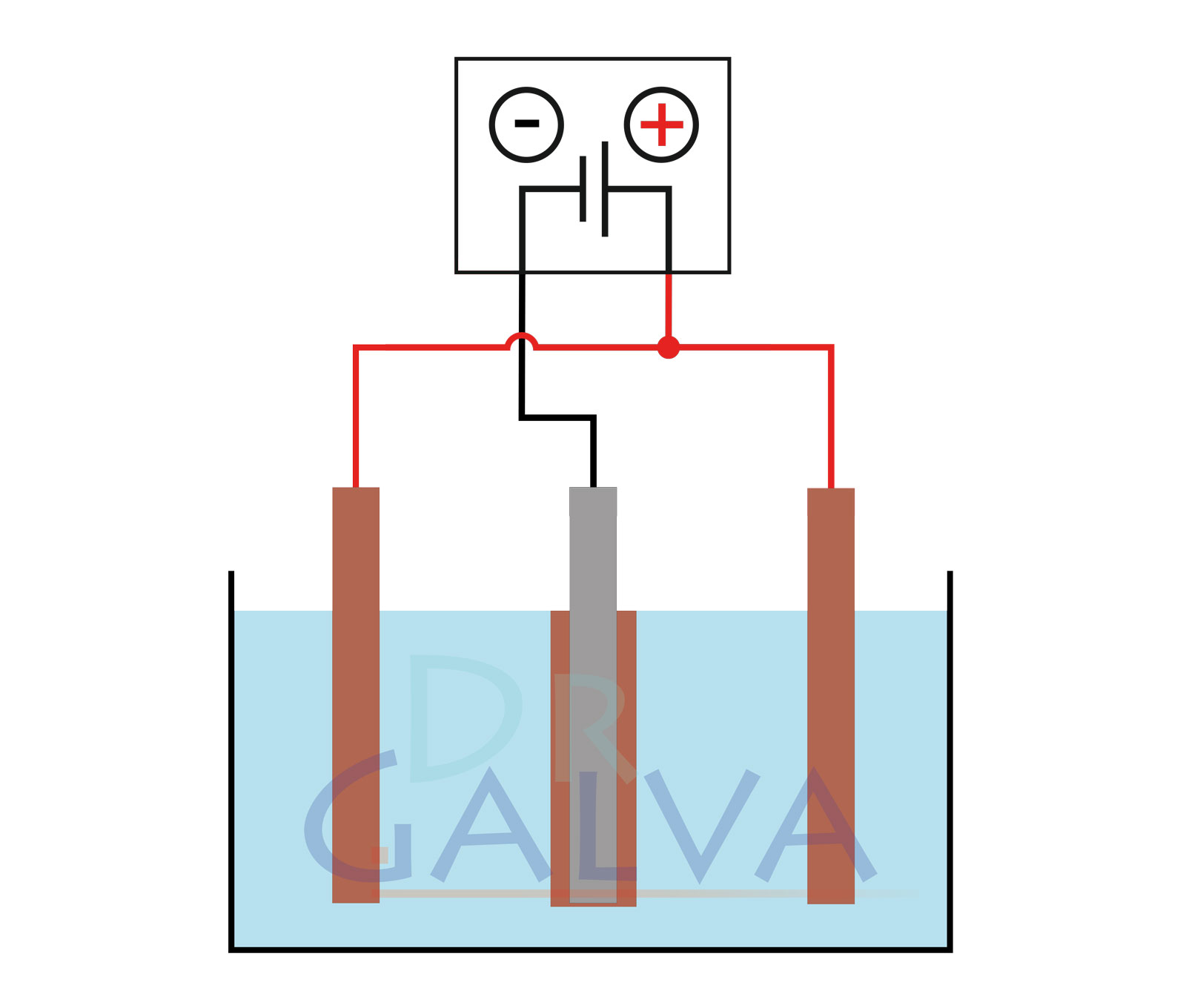
- Comment construire une cellule de galvanisation pour déposer des métaux ?
-
Une cellule galvanique pour le dépôt de métaux, également appelée cellule électrolytique ou cellule de galvanisation, est un dispositif utilisé pour déposer une couche de métal sur un autre métal grâce à un processus électrochimique. Voici un guide étape par étape pour construire une telle cellule :
Matériaux :
- Source de courant: une source de tension continue réglable.
- Anode: par exemple, une anode en cuivre si le cuivre doit être déposé, pour certaines solutions, il faut aussi utiliser une autre anode - fais attention aux indications concernant l'électrolyte.
- Cathode (pièce): La pièce de métal sur laquelle l'autre métal doit être déposé (par exemple un bijou).
- Solution électrolytique: une solution qui contient des ions métalliques du métal à déposer (par exemple, l'électrolyte de cuivre pour le dépôt de cuivre).
- Récipient: pour contenir la solution d'électrolyte.
- Fils conducteurs et pinces crocodiles: Pour connecter les électrodes à la source de courant.
Mise en place :
-
Préparation de la solution d'électrolyte:
- Remplis le récipient avec la solution d'électrolyte. Pour le dépôt de cuivre, tu peux par exemple utiliser un électrolyte de cuivre.
- Remplis le récipient avec la solution d'électrolyte. Pour le dépôt de cuivre, tu peux par exemple utiliser un électrolyte de cuivre.
-
Mise en place des électrodes:
-
Anode: insère les anodes (par exemple la plaque de cuivre) dans la solution. Ces électrodes fourniront le métal qui doit être déposé. Il convient d'utiliser deux anodes opposées pour obtenir un dépôt plus régulier. Observe les graphiques à ce sujet. (S'il n'est pas possible d'obtenir une telle disposition des anodes, il est possible d'obtenir un revêtement uniforme de la pièce en la faisant tourner en continu).
Consulte également la section " La dispersion en galvanisation " -
Cathode: place également la cathode (par exemple le bijou) dans la solution. Il s'agit de la pièce sur laquelle le métal est déposé.
-
Anode: insère les anodes (par exemple la plaque de cuivre) dans la solution. Ces électrodes fourniront le métal qui doit être déposé. Il convient d'utiliser deux anodes opposées pour obtenir un dépôt plus régulier. Observe les graphiques à ce sujet. (S'il n'est pas possible d'obtenir une telle disposition des anodes, il est possible d'obtenir un revêtement uniforme de la pièce en la faisant tourner en continu).
-
Connexion à la source de courant:
- Connecte l'anode (plaque de cuivre) au pôle positif de la source de courant.
- Connecte la cathode (pièce à travailler) au pôle négatif de la source de courant. La cathode est ainsi chargée négativement, ce qui entraîne le dépôt du métal sur celle-ci.
-
Allume le courant électrique:
- Allume la source de courant. Les ions métalliques dans la solution (par exemple, les ions Cu²⁺) sont attirés par la cathode, car elle est chargée négativement. Les ions sont réduits en atomes métalliques neutres et se déposent sur la surface de la cathode.
Fonctionnement :
- Anode (plaque de cuivre): L'anode se dissout partiellement sous l'effet du flux de courant, libérant des ions de cuivre (Cu²⁺) dans la solution, ce qui permet de maintenir une concentration constante d'ions de cuivre dans la solution électrolytique :
Cu → Cu²⁺ + 2e⁻
- Cathode (pièce à usiner): À la cathode, les ions de cuivre (Cu²⁺) de la solution sont réduits par les électrons et déposés sur la pièce sous forme de cuivre métallique :
Cu²⁺ + 2e⁻ → Cu
Remarques importantes :
- Intensité du courant et durée: l'intensité du courant et la durée du processus déterminent l'épaisseur de la couche métallique déposée. Des intensités de courant plus élevées et des durées plus longues permettent d'obtenir des couches plus épaisses.
- Température: la température de la solution électrolytique peut influencer le taux de dépôt. Des températures plus élevées peuvent accélérer le processus, mais aussi affecter la qualité de la couche.
- Pureté de la solution électrolytique: les impuretés dans la solution peuvent affecter la qualité de la couche métallique déposée.
Résultat :
Grâce à cette structure, une couche métallique uniforme est déposée sur la pièce. C'est le principe de base de la galvanisation, utilisé dans de nombreux processus industriels pour revêtir les métaux et protéger ou améliorer les surfaces.
Construction générale :
Comparaison de la déposition :
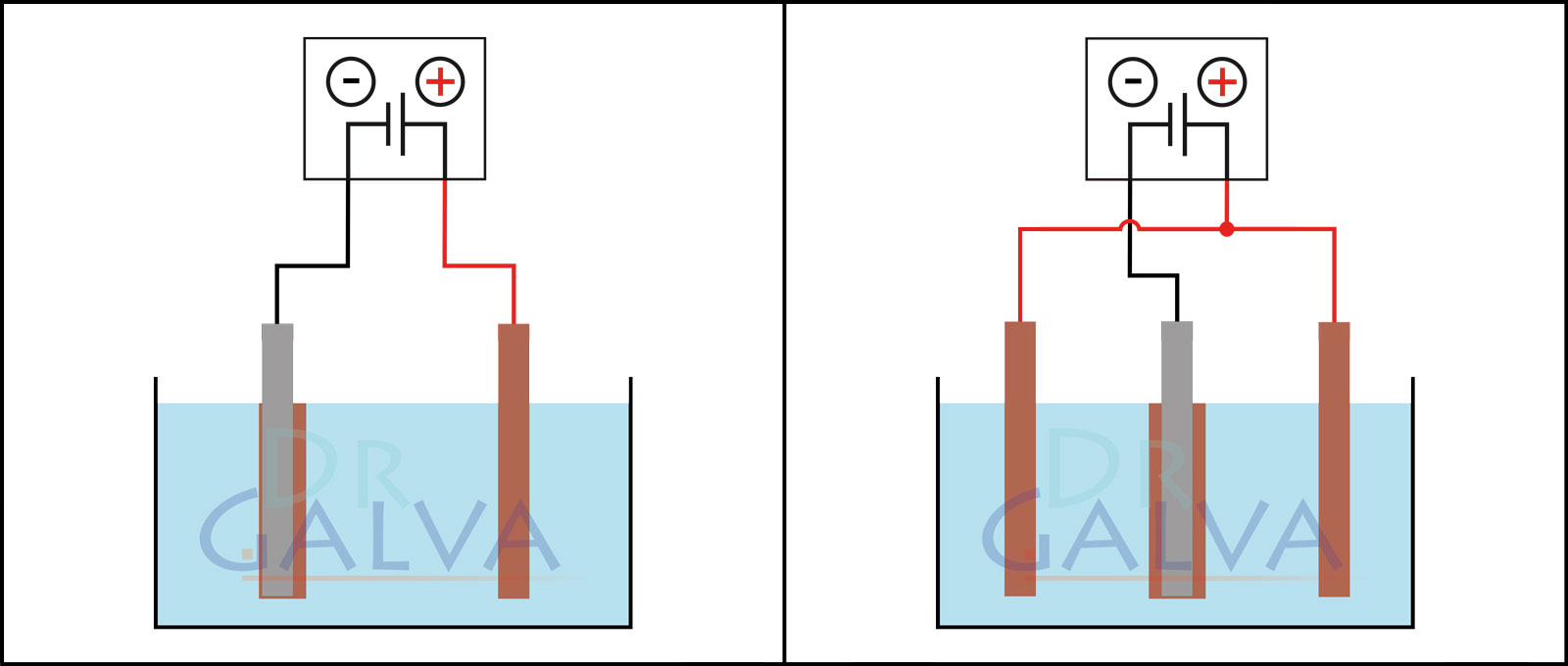
L'anode et la pièce à usiner occupent une position opposée l'une à l'autre. Plus de métal est déposé sur la face avant de la pièce que sur la face arrière. La pièce à usiner doit être tournée à intervalles réguliers. Deux anodes et la pièce à usiner se trouvent dans la cuve. Il convient de noter que les deux anodes doivent être reliées au même bloc d'alimentation. La pièce à usiner est placée au centre, entre les deux anodes. Cela permet de garantir une séparation plus uniforme. - Dégraissage correct des surfaces à revêtir
-
Le dégraissage correct des surfaces à revêtir est une étape cruciale du processus de galvanisation. Un nettoyage en profondeur est nécessaire pour assurer une adhérence parfaite du revêtement métallique et garantir la qualité des produits finis. Voici les principales étapes et méthodes pour un dégraissage efficace :
Pourquoi le dégraissage est-il important ?
- Adhésion : les résidus de graisse et d'huile peuvent considérablement réduire l'adhésion du revêtement galvanique.
- Qualité du revêtement : les impuretés entraînent des revêtements irréguliers, la formation de bulles et d'autres défauts.
- Protection contre la corrosion : des surfaces propres garantissent une meilleure résistance à la corrosion des matériaux revêtus.
Méthodes de dégraissage
1. dégraissage chimique
- Nettoyage au solvant : Utilisation de solvants organiques tels que l'acétone ou l'isopropanol, qui dissolvent efficacement les graisses et les huiles.
- L'acétone se distingue par son excellente solubilité des graisses et son faible point d'ébullition. Elle est principalement utilisée à l'institut pour le nettoyage ou le dégraissage des outils de travail. L'acétone dissout bien les empreintes digitales et autres graisses légères, mais elle est moins efficace contre l'huile des machines. En fait, l'acétone peut être contre-productive sur les pièces souillées par l'huile, car elle peut faire adhérer durablement les particules de saleté à la surface par des forces d'adhérence.
- L'isopropanol (propan-2-ol) peut être utilisé dans différentes disciplines et est particulièrement polyvalent. Il est par exemple utilisé pour nettoyer les écrans ou pour enlever les autocollants gênants qui laissent sinon des traces de colle désagréables. L'isopropanol est particulièrement adapté aux tâches tenaces pour lesquelles les autres produits échouent, car il élimine complètement les résidus. L'isopropanol ne laisse pas de traces, car il s'évapore sans laisser de résidus, et son comportement chimique est neutre avec la plupart des matériaux. Il peut être dilué avec de l'eau distillée et convient bien à l'élimination des huiles et des graisses ainsi qu'au nettoyage de nombreuses surfaces.
- Dégraissage alcalin : utilisation de nettoyants alcalins qui émulsifient et éliminent les graisses et les huiles en solution aqueuse.
- Bains acides : dans certains cas, utilisation de détergents acides, notamment lorsqu'il s'agit d'éliminer des oxydes métalliques ou de la rouille.
2. dégraissage mécanique
- Brossage et ponçage : utilisation de brosses ou d'abrasifs pour éliminer les grosses impuretés.
- Grenaillage : Utilisation d'abrasifs tels que des billes de verre ou du sable pour nettoyer la surface en profondeur.
3. dégraissage électrolytique
- Dégraissage anodique : Les pièces sont suspendues comme anode dans une solution alcaline et soumises à un courant électrique, ce qui permet d'éliminer les graisses et les huiles par dégagement de gaz.
- Dégraissage cathodique : Les pièces sont utilisées comme cathode, ce qui permet souvent un nettoyage plus doux.
Étapes du dégraissage
1. préparation
- Élimination de la saleté grossière et des impuretés visibles par rinçage ou nettoyage mécanique.
2. dégraissage chimique ou mécanique
- Application de la méthode de dégraissage choisie en fonction des exigences spécifiques du matériau et de la contamination. Pour les pièces souillées d'huile, il convient de choisir des solvants ou des méthodes de dégraissage alternatifs plus efficaces que l'acétone.
3. rinçage
- Rincer soigneusement les pièces avec de l'eau distillée ou désionisée pour éliminer tous les résidus du dégraissant.
4. séchage
- Sécher soigneusement la surface afin d'éviter les taches d'eau ou les nouvelles contaminations.
Conseils pour un résultat optimal
- Contrôle de la température : de nombreux processus de dégraissage sont plus efficaces à des températures élevées.
- Environnement contrôlé : travailler dans un environnement propre permet d'éviter une nouvelle contamination.
- Contrôle de la qualité : contrôle régulier de la propreté de la surface, par exemple par le test de la goutte d'eau ou la mesure de l'angle de contact.
En respectant ces étapes et ces méthodes, vous vous assurez que les surfaces à revêtir sont préparées de manière optimale, ce qui permet d'obtenir un revêtement galvanique de haute qualité et de longue durée.
- Comment utiliser les électrolytes galvaniques ?
-
Les électrolytes s'utilisent non dilués, car il s'agit de solutions prêtes à l'emploi. Les paramètres respectifs de l'électrolyte sont indiqués sur le flacon, ainsi que l'anode nécessaire. Les valeurs de tension peuvent varier, car la loi d'Ohm s'applique dans les solutions. La résistance est ici déterminante et, selon la distance, le flux de courant peut augmenter ou diminuer. Cela devient encore plus précis si l'on travaille sur la densité de courant.
De même, les électrolytes sont enrichis par la dissolution de l'anode métallique, ce qui augmente la portée (sauf pour les anodes insolubles ou les anodes en métal étranger).
Il faut également tenir compte du fait que le courant emprunte le chemin le plus court.
- Quelle surface peut-on revêtir avec un électrolyte galvanique ?
-
La quantité de matériau pouvant être déposée avec un électrolyte galvanique dépend de plusieurs facteurs :
Facteurs clés
- Intensité du courant et durée du revêtement : Selon la loi de Faraday, la quantité de métal déposée est directement proportionnelle à la charge électrique (courant × temps).
- Composition de l'électrolyte : La teneur en ions métalliques de l'électrolyte détermine sa durée d'utilisation avant qu'un réapprovisionnement ou une régénération ne soit nécessaire.
- Efficacité du processus : Les taux de dépôt varient selon le métal et l'électrolyte (par exemple, le cuivre et le nickel ont une efficacité plus élevée que le chrome).
- Épaisseur de la couche : Plus la couche est épaisse, plus la consommation de matériau est importante.
Exemple
Un litre d'électrolyte de cuivre contenant 100 g/l de cuivre peut théoriquement revêtir :
- 0,1 m² avec une épaisseur de couche de 100 µm ou
- 1 m² avec une épaisseur de couche de 10 µm.
Remarque importante
La surface de revêtement réelle est souvent considérablement plus grande lorsque les anodes appropriées sont utilisées. Avec des anodes solubles (par exemple, en nickel ou en cuivre), le métal déposé est continuellement reconstitué, permettant ainsi à l'électrolyte de se régénérer pendant le processus et d'être utilisé pendant une période beaucoup plus longue.
- Les électrolytes sont-ils réutilisables ?
-
Les électrolytes sont réutilisables plusieurs fois. Veille à ne pas introduire d'impuretés par des salissures ou des anodes inappropriées. Il peut également arriver que la pièce se dissolve dans l'électrolyte si le choix n'est pas approprié (p. ex. acier galvanisé dans un électrolyte fortement acide).
- Les anodes peuvent-elles être utilisées plusieurs fois ?
-
Oui, les anodes en galvanoplastie peuvent être utilisées plusieurs fois. La réutilisation des anodes est économiquement viable tant qu'elles peuvent fournir efficacement des ions métalliques. Voici quelques directives générales :
-
Matériau de l'Anode : Les anodes sont souvent fabriquées à partir du même matériau que celui qui doit être déposé (par exemple, nickel, cuivre, zinc). Ces anodes sont consommées au cours du processus de galvanoplastie, car elles libèrent des ions métalliques dans le bain, qui se déposent ensuite sur la pièce à travailler (cathode).
-
Usure de l'Anode : Avec le temps, les anodes se dissolvent partiellement dans l'électrolyte, car elles sont la source d'ions métalliques pour le processus de revêtement. Le taux d'usure dépend de la densité de courant, de la durée du processus de galvanoplastie et du type d'électrolyte utilisé.
-
Entretien et Maintenance : Les anodes doivent être inspectées régulièrement et nettoyées si nécessaire pour éliminer les couches d'oxyde ou les dépôts qui pourraient nuire à leur efficacité. Un entretien adéquat peut prolonger la durée de vie des anodes.
-
Type de Procédé de Galvanoplastie : Certains procédés nécessitent un renouvellement plus fréquent des anodes que d'autres. Par exemple, les anodes utilisées dans le nickelage s'usent plus lentement que dans les procédés à densités de courant plus élevées ou avec des exigences chimiques spécifiques.
- Remplacement des Anodes : Si les anodes sont trop usées ou si leur performance diminue, elles doivent être remplacées pour garantir un revêtement uniforme et de haute qualité.
En général, les anodes en galvanoplastie peuvent être utilisées plusieurs fois, à condition qu'elles soient en bon état et fonctionnent efficacement. Une inspection et un entretien réguliers sont essentiels pour maximiser la durée de vie des anodes.
-
Matériau de l'Anode : Les anodes sont souvent fabriquées à partir du même matériau que celui qui doit être déposé (par exemple, nickel, cuivre, zinc). Ces anodes sont consommées au cours du processus de galvanoplastie, car elles libèrent des ions métalliques dans le bain, qui se déposent ensuite sur la pièce à travailler (cathode).
- D'autres métaux sont-ils possibles comme anodes ?
-
En galvanisation, il est essentiel de n'utiliser que des anodes spécialement conçues pour le processus en question. Les autres matériaux d'anode ne sont pas autorisés, car ils se dissolvent dans l'électrolyte et peuvent ainsi le contaminer. Cette contamination entraîne un revêtement de mauvaise qualité et peut affecter considérablement l'ensemble du processus de galvanisation. Il est donc important d'utiliser les anodes prescrites pour garantir la qualité et la pureté du revêtement galvanique.
- Est-il possible d'enduire de petites choses avec un grand bloc d'alimentation ?
-
Oui, il est possible de revêtir de petits objets avec un bloc d'alimentation de grande taille, mais il est important de réguler soigneusement l'intensité du courant. Un bloc d'alimentation puissant peut fournir plus de courant que nécessaire pour les petits objets, ce qui peut entraîner une surcouche, des couches irrégulières ou même des dommages à la pièce.
Il est recommandé de régler le courant à la densité de courant (courant par surface) requise pour le matériau et la solution concernés afin d'obtenir un revêtement contrôlé et uniforme. Un bon bloc d'alimentation doit permettre d'ajuster finement la tension et le courant afin que même les petits objets puissent être revêtus de manière sûre et précise.
- Puis-je utiliser une batterie au lieu d'un bloc d'alimentation réglable ?
-
Alors qu'il est théoriquement possible d'utiliser une batterie à la place d'une alimentation réglable pour la galvanisation, nous le déconseillons fortement. La raison en est qu'il n'est pas possible de réguler précisément la tension et l'intensité du courant, ce qui est essentiel pour une galvanisation réussie.
Raisons pour lesquelles une batterie n'est pas appropriée :
- Pas de contrôle de la tension : les piles fournissent une tension fixe (par exemple 1,5V pour une pile AA ou 12V pour une batterie de voiture). Étant donné qu'en galvanoplastie, la tension doit souvent être ajustée pour contrôler la qualité du revêtement, la tension fixe d'une pile donne souvent des résultats sous-optimaux. Cela peut entraîner des couches irrégulières, un développement incontrôlé de gaz (comme la formation de bulles) et d'autres effets indésirables.
- Intensité incontrôlée du courant : l'intensité du courant dépend de la tension de la batterie et de la résistance du bain électrolytique. Sans possibilité de réguler le courant avec précision, le flux de courant peut être trop élevé, ce qui peut endommager le revêtement, ou trop faible, ce qui rend le processus inefficace.
- Baisse de la puissance : au cours de l'utilisation, la puissance de la batterie diminue, ce qui entraîne une baisse de la tension. Cela affecte directement la qualité et l'uniformité du revêtement et peut rendre le processus imprévisible.
- Risque de mauvais revêtements : L'absence de possibilité de régulation augmente considérablement le risque de mauvais revêtements ou même d'endommagement de la pièce. Cela peut entraîner une perte de matériau inutile et des coûts supplémentaires.
Conclusion :
Pour obtenir des résultats de galvanisation de haute qualité et cohérents, il est essentiel de pouvoir contrôler la tension et le courant avec précision. Une batterie qui n'offre pas de possibilités de régulation ne peut pas répondre à ces exigences et donne souvent des résultats insatisfaisants. C'est pourquoi nous recommandons l'utilisation d'une alimentation réglable, spécialement conçue pour les exigences de la galvanisation, afin d'obtenir des résultats optimaux.
- Peut-on mélanger différents électrolytes ?
-
Les électrolytes ne doivent pas être mélangés, car ils sont chimiquement et électrochimiquement incompatibles. En particulier, les électrolytes alcalins et acides ne doivent pas être combinés – leurs niveaux de pH différents peuvent provoquer des réactions indésirables, telles que la précipitation de métaux ou d'autres substances. Cela rend l’électrolyte inutilisable et peut entraîner des revêtements défectueux ou irréguliers.
Il n'est pas non plus possible de mélanger différents électrolytes métalliques. Par exemple, les électrolytes de cuivre et de zinc ne peuvent pas simplement être combinés pour déposer du laiton. Les ions métalliques se comportent différemment dans la solution, empêchant ainsi la formation d'un alliage homogène.
De plus, les additifs contenus dans les électrolytes sont précisément formulés pour un pH et un type d’électrolyte spécifiques. Le mélange d'électrolytes altère leur efficacité et fait perdre à l’électrolyte ses propriétés d’origine.
- A quoi reconnaît-on que l'électrolyte est usé ?
-
<p>L’épuisement se manifeste souvent par un dépôt plus lent ou un changement de couleur de la couche métallique déposée. La couleur initiale de l’électrolyte peut également s’estomper, ou la brillance du revêtement peut diminuer.</p>
<p>Pour maintenir constant le contenu en métal, il convient d’utiliser en permanence une anode métallique appropriée. Celle-ci se dissout lentement au cours du procédé et enrichit l’électrolyte en ions métalliques nécessaires. Avec le temps, cependant, des impuretés apparaissent (ions étrangers, résidus organiques, polymérisation) et les agents de brillance (le cas échéant) sont consommés.</p>
<p>Pour ce cas, nous proposons des additifs de brillance qui complètent spécifiquement les agents de brillance manquants ainsi que d’autres additifs.</p>
<p>Avec les électrolytes à anodes insolubles (par ex. or), il n’y a pas d’apport automatique de métal.</p>
<p>Les électrolytes au chrome ne peuvent également être régénérés qu’avec beaucoup d’efforts. Cependant, comme le chrome est généralement appliqué uniquement en fine couche de finition sur le nickel, cela joue un rôle secondaire.</p>
- Élimination des solutions
-
Les solutions usagées peuvent être déposées dans un centre de collecte des déchets toxiques. Les petites quantités peuvent généralement être éliminées diluées avec les eaux usées.
Renseigne-toi toutefois impérativement sur les conditions en vigueur dans ta région.
- Où puis-je trouver la fiche de données de sécurité ?
-
Tu le trouveras sur la page de l'article dans l'onglet "Documents", où tu pourras le télécharger/l'ouvrir directement.
- Les plastiques peuvent-ils être revêtus par électrodéposition ?
-
Oui, il est possible de galvaniser des pièces en plastique. À l’origine, la surface des plastiques était gravée à l’acide chromique, puis activée avec du palladium. Cependant, ces substances étant très toxiques et nocives pour l’environnement, une méthode plus respectueuse de l’environnement est de plus en plus utilisée : un vernis conducteur. Le vernis conducteur rend le plastique électroconducteur sans avoir recours à des produits chimiques nocifs. Ce procédé est donc nettement plus sûr et plus durable.
Processus de galvanisation des plastiques avec vernis conducteur :
- Préparation de la surface : Le plastique est soigneusement nettoyé pour éliminer les graisses, la poussière et autres contaminants pouvant nuire à l’adhérence.
- Application du vernis conducteur : Un vernis conducteur spécial, contenant des particules métalliques (par exemple des particules de cuivre ou d'argent), est appliqué uniformément sur la surface du plastique. Ce vernis rend la surface électroconductrice et sert de base au processus de galvanisation.
- Revêtement initial (par ex. cuivre acide) : La surface traitée avec le vernis conducteur est ensuite galvanisée avec une fine couche de cuivre acide pour assurer une conductivité stable et continue.
- Galvanisation : Le plastique peut maintenant être recouvert de la couche de métal souhaitée (par ex. nickel, suivi de chrome ou d’or). L’épaisseur de la couche et le choix du métal sont ajustés en fonction des exigences esthétiques et fonctionnelles spécifiques.
Avantages du procédé avec vernis conducteur :
- Plus respectueux de l’environnement : En éliminant l’acide chromique et le palladium, cette méthode réduit considérablement l’impact environnemental et les risques pour la santé.
- Application flexible : Le vernis conducteur peut être appliqué sur différents types de plastique, permettant un revêtement uniforme.
- Efficace : La transition directe du vernis conducteur à la galvanisation permet un processus plus rapide et plus économique.
Domaines d'application :
- Industrie automobile : Pièces en plastique chromé, comme les garnitures et les emblèmes, fabriquées sans produits chimiques nocifs.
- Biens de consommation et électronique : Amélioration et fonctionnalisation des boîtiers en plastique et des éléments décoratifs.
L’utilisation de vernis conducteurs comme alternative à l’acide chromique et au palladium constitue une solution durable et prometteuse pour de nombreuses applications de galvanoplastie sur plastique.
- Galvanisation de l'acier inoxydable
-
L’acier inoxydable peut être galvanisé, mais il nécessite un prétraitement spécifique. La couche d'oxyde passif sur l'acier inoxydable empêche l'adhérence des revêtements métalliques. La méthode la plus efficace pour réussir le dépôt est d’utiliser un Nickel-Strike comme couche d’activation.
Guide étape par étape
1. Nettoyage de la surface
- Éliminer les graisses, huiles ou contaminants avec un nettoyant approprié.
- Rincer soigneusement à l’eau déionisée.
2. Nickel-Strike comme promoteur d'adhérence
- Une fine couche de nickel est déposée électrolytiquement.
- Cela crée une surface active et empêche le décollement du revêtement.
- Après le Nickel-Strike, la pièce doit être immédiatement transférée au bain de galvanisation suivant, sans rinçage.
3. Application du revêtement principal
Après le Nickel-Strike, la couche métallique souhaitée peut être déposée :
- Nickel pour des revêtements décoratifs ou résistants à la corrosion.
- Cuivre comme couche intermédiaire pour d'autres revêtements.
- Chrome pour des surfaces brillantes et résistantes à l'usure (une couche dense de nickel est recommandée).
- Zinc ou zinc-nickel pour la protection contre la corrosion.
Pourquoi le Nickel-Strike est-il nécessaire ?
- L’acier inoxydable possède une couche passive d’oxyde de chrome qui empêche la déposition directe du métal.
- Le Nickel-Strike élimine cette couche et assure une surface favorable à l'adhérence.
- Sans Nickel-Strike, le revêtement de galvanisation ne tient généralement pas de manière permanente sur l'acier inoxydable.
- Comment revêtir l'aluminium ?
-
Dès que l'aluminium non revêtu entre en contact avec l'oxygène, un processus d'oxydation se met en place. Or, ce processus entrave le revêtement. C'est pourquoi les pièces en aluminium nécessitent toujours un prétraitement avec un activateur d'aluminium. Celui-ci élimine la couche d'oxyde et crée dans le même processus une couche de zinc à la surface du matériau. De cette manière, l'activateur empêche le contact avec l'oxygène et protège contre une nouvelle oxydation. Afin d'éviter de manière fiable la formation ultérieure de bulles sous le revêtement, nous proposons à nos clients un activateur d'aluminium à faible viscosité.
Toutefois, le zinc n'est pas résistant aux acides. C'est pourquoi vous appliquez dans l'étape suivante une couche de cuivre alcalin/basique, puis une couche de Cuivre électrolyte acide. Vous créez ainsi une base stable pour d'éventuelles couches supplémentaires.
En fonction de l'alliage d'aluminium, il est nécessaire de graver la surface dans un premier temps avant d'appliquer la couche de zinc avec l'activateur d'aluminium. La couche de zinc appliquée est gravée une nouvelle fois et le traitement avec l'activateur est répété une deuxième fois. Cela se fait parce que la couche de zincate devient relativement rugueuse et que les pores se ferment mieux. Malheureusement, le processus de zingage est considéré comme compliqué.
Pour chromer ou dorer l'aluminium, il faut donc suivre la séquence suivante :
- Conditionneur pour la décapage
- Activateur d'aluminium pour créer la couche de zincate
- Electrolyte de cuivre alcalin pour obtenir une couche de cuivre protectrice contre les acides
- Electrolyte de cuivre brillant (acide)
- Electrolyte de nickel (Free-Nickel), comme couche de barrière de diffusion
- Electrolyte de chrome ou électrolyte d'or comme couche finale
- Activateur d’aluminium pour revêtements électrolytiques
-
Principe de fonctionnement
Le zincate forme sur l’aluminium un film d’échange de zinc mince et adhérent, empêchant la réoxydation immédiate de l’Al et rendant la surface conductrice/active pour les couches électrolytiques suivantes (p. ex., cuivre alcalin).
Principe de base (chimie)
En solution fortement alcaline (NaOH/KOH), la matrice d’Al proche de la surface se dissout en aluminate ; simultanément, du zinc élémentaire se dépose à partir du Zn complexé (p. ex., Zn(OH)42−) sur la surface → couche d’échange.
Chaîne de procédé standard (galvanique)
- Dégraissage (alcalin), rinçage soigné.
- Décapage alcalin (court), rinçage.
- Désoxydation/désmutage (p. ex., avec conditionneur ou nitrique), rinçage.
- Zincate (typ. 30–90 s ; rester bref pour éviter un film fragile).
- Double zincate pour les alliages difficiles : décaper/activer → zincater à nouveau. (Le premier film est souvent non adhérent et peut s’essuyer.)
- Brève activation (légèrement acide), passer humide sur humide vers la galvanoplastie sans séchage.
-
Strike électrolytique à faible densité de courant :
- Strike cuivre cyanure (classique, très fiable ; toxique/impact environnemental) ou
- Cuivre alcalin
- Puis couches principales : p. ex., cuivre brillant d’épaisseur, nickel/chrome décoratif, etc.
Dépendances liées à l’alliage
- Fonderie Al-Si (Si élevé), Al-Mg, alliages d’Al à haute résistance : presque toujours double zincate ; étape de désoxydation possiblement plus longue.
- Surfaces fraîchement coulées/sablées : activer soigneusement pores et îlots de silicium ; ajuster les temps de décapage/désoxydation.
Défauts typiques & remèdes
- Décollements/cloques : zincate trop épais/vieilli, oxydes/saletés, longs temps d’attente/séchage → temps de zincate plus courts, bains frais, transfert humide-sur-humide rapide (≤ 1–2 min).
- Gris foncé : zincate épuisé, activation insuffisante → renouveler le zincate, optimiser l’activation.
- Rugosité/attaques de bords : chimie de décapage trop agressive/trop longue → corriger temps/formulations.
Conduite du bain (zincate)
- Fortement alcalin, contient des complexes de Zn ; la charge en aluminate augmente avec le temps → baisse d’activité.
- Mesures : filtration, renouvellements partiels/appoints, temps de contact courts, température/alcalinité stables.
Sécurité/Environnement
Le zincate est corrosif → utiliser des EPI (gants, lunettes, tablier), éviter les projections. Maintenir des rinçages alcalins/propres ; traiter correctement les effluents contenant Zn/Al. Les strikes cyanurés exigent des mesures strictes de sécurité et de traitement des effluents.
- Comment galvaniser l'impression 3D ?
-
L'électrodéposition d'objets imprimés en 3D est un processus en plusieurs étapes qui nécessite certains équipements et matériaux spécialisés. Voici les étapes de base de l'électrodéposition d'un objet imprimé en 3D :
1. préparation de l'objet imprimé en 3D
- Nettoyage : Nettoyer soigneusement l'objet afin d'éliminer toute poussière, huile ou autre contaminant. Cela peut se faire avec de l'alcool isopropylique ou un autre produit de nettoyage approprié.
- Lisser : Si nécessaire, lissez la surface de l'objet imprimé en 3D afin de garantir un revêtement uniforme. Cela peut être réalisé par ponçage ou par lissage chimique.
2. appliquer une couche conductrice
- Peinture conductrice pulvérisable : appliquez une peinture ou une encre conductrice sur l'objet. Cette peinture contient souvent du cuivre, de l'argent ou du graphite pour rendre la surface conductrice.
- Matériaux de revêtement conducteurs : vous pouvez également plonger l'objet dans une solution conductrice ou le vaporiser avec un revêtement conducteur.
3. préparation à la galvanisation
- Fixer l'anode et la cathode : Fixez l'objet imprimé en 3D comme cathode dans votre bain de galvanisation. L'anode est généralement constituée du métal que vous souhaitez appliquer sur l'objet (par exemple cuivre, nickel). Consultez les données relatives à la solution.
- Solution électrolytique : assurez-vous que vous utilisez la solution électrolytique appropriée pour le métal que vous souhaitez appliquer. Chaque revêtement métallique nécessite une solution spécifique.
4. processus galvanique
- Source de courant : connectez l'anode et la cathode à une source de courant continu. Le flux de courant permet de transférer les ions métalliques de l'anode à l'objet.
- Régler les paramètres : Réglez les bons paramètres (intensité du courant / tension) afin d'obtenir un revêtement uniforme.
5. traitement ultérieur
- Nettoyage : Retirer l'objet du bain de galvanisation et le rincer soigneusement à l'eau afin d'éliminer tous les résidus de la solution électrolytique.
- Polir et sceller : Polir la surface revêtue pour obtenir la brillance souhaitée et, si nécessaire, la sceller avec un vernis transparent ou un autre revêtement protecteur.
Matériaux et équipement
- Peinture conductrice
- bain de galvanisation et solution électrolytique
- anode adaptée à l'électrolyte
- Source de courant continu
- Produits de nettoyage et outils de polissage
Consignes de sécurité
- Équipement de protection : portez un équipement de protection approprié, notamment des gants, des lunettes de protection et un appareil respiratoire pour vous protéger.
- Ventilation : assurez-vous que la zone de travail est bien ventilée afin de minimiser les vapeurs des produits chimiques utilisés.
L'électrodéposition peut améliorer considérablement les propriétés mécaniques et esthétiques des objets imprimés en 3D. Si vous suivez attentivement ces étapes, vous pourrez réaliser des pièces imprimées en 3D avec un revêtement métallique de haute qualité.
- Comment revêtir le chrome ?
-
Une surface chromée n'offre pas une adhérence suffisante aux nouveaux revêtements. Il est donc nécessaire d'éliminer la couche de chrome existante. Pour cette opération, utilisez des décapants pour chrome spécialement conçus à cet effet. Ces solutions de décapage sont particulièrement sûres à utiliser. Des additifs spéciaux empêchent par exemple la formation de chrome hexavalent hautement toxique.
En règle générale, une couche de nickel se trouve sous l'ancienne couche de chrome. Celle-ci doit être réactivée pour le nouveau revêtement à l'aide d'un activateur spécialement conçu à cet effet. Afin d'éviter la formation d'une nouvelle couche d'oxyde, la pièce est revêtue immédiatement après la réactivation de la couche de nickel.
Il existe aussi une alternative, le strike or, qui peut être appliqué directement sur le chrome. Celles-ci sont basées sur le fait que la couche d'oxyde est réduite au cours du processus et que de l'or est déposé en même temps.
- Pourquoi pas d’anode en chrome ? Et pourquoi une anode en aluminium est-elle autorisée ?
-
Chromage trivalent : Choix des anodes
Dans les électrolytes de chrome trivalent, les conditions chimiques et électrochimiques diffèrent de celles des bains classiques de chrome hexavalent. Par conséquent, les anodes doivent être choisies de manière à ne pas perturber la composition du bain et à ne pas produire de substances dangereuses pour la santé.
Pourquoi pas d’anode en chrome dans des électrolytes de chrome trivalent ?
-
Comportement de dissolution du chrome
Dans les bains de chrome trivalent, le chrome est déjà présent à l’état d’oxydation +III, qui est relativement stable. Cependant, une anode en chrome pourrait entraîner une oxydation incontrôlée en chrome(VI) :-
Chrome(VI) (chrome hexavalent) est hautement toxique et cancérigène. Même de petites quantités dans le bain représentent dès lors un risque majeur pour la santé et l’environnement.
-
Chrome(VI) (chrome hexavalent) est hautement toxique et cancérigène. Même de petites quantités dans le bain représentent dès lors un risque majeur pour la santé et l’environnement.
-
Stabilité du bain
Les bains de chrome trivalent sont délibérément formulés pour contenir très peu, voire pas du tout, de Cr(VI). Une anode en chrome perturberait cet équilibre, puisqu’au cours de l’oxydation électrochimique, du Cr(VI) peut se former. Cela nuit à la qualité du dépôt et présente des dangers importants.
-
Pratique : anodes inertes ou spéciales
- Anodes en platine ou en iridium constituent d’excellentes anodes inertes, car elles sont extrêmement résistantes à l’électrolyte et ne libèrent pratiquement aucun matériau. Elles sont cependant onéreuses.
- Anodes en graphite sont également souvent utilisées, mais peuvent parfois libérer de fines particules de graphite dans le bain (érosion/usure). Celles-ci peuvent se déposer sur la surface de la pièce et entraîner des dépôts sombres.
Pourquoi une anode en aluminium est-elle permise ?
-
Couche d’oxyde protectrice (passivation)
L’aluminium forme à sa surface une couche dense d’oxyde d’aluminium (Al₂O₃). Cette couche passive le métal et réduit considérablement la dissolution d’ions aluminium dans le bain.
-
Faible perturbation de la chimie du bain
Aux tensions et pH habituels dans les électrolytes de chrome trivalent, l’aluminium demeure en grande partie passif. Ainsi, seules de faibles quantités d’ions Al³⁺ pénètrent dans l’électrolyte, ce qui influence très peu la composition ou le pH du bain.
-
L’aluminium se dissout, mais ne se dépose pas
Bien qu’une certaine quantité d’aluminium passe effectivement sous forme d’Al³⁺ dans le bain, il ne se dépose pratiquement pas comme couche métallique dans une solution aqueuse.- La déposition d’aluminium à partir de solutions aqueuses est très difficile d’un point de vue thermodynamique, car l’eau est plus facilement réduite (dégagement d’hydrogène).
- Par conséquent, il ne se forme pas de couche indésirable d’aluminium sur les pièces.
-
Disponibilité et coûts
L’aluminium est bon marché, facile à travailler et—dans la mesure où la passivation fonctionne correctement—un matériau d’anode pratique pour les bains de chrome trivalent.
Conclusion
- Une anode en chrome dans un bain de chrome trivalent mènerait à la formation indésirable de Cr(VI), extrêmement dangereux pour la santé.
- Anodes en aluminium sont permises grâce à leur couche d’oxyde protectrice, qui ne contamine pratiquement pas l’électrolyte et ne produit pas de sous-produits toxiques.
- Anodes en platine et en iridium sont considérées comme des anodes inertes très durables, mais coûteuses.
- Anodes en graphite sont relativement économiques, mais peuvent libérer des particules de graphite dues à l’usure, entraînant des dépôts sombres.
-
Comportement de dissolution du chrome
- Chromage électrolytique - DIY deluxe : étape par étape pour une finition chromée parfaite !
-
La galvanisation est une méthode fiable pour obtenir des finitions chromées uniques. Avec ce guide de bricolage, nous vous proposons des instructions simples, étape par étape, pour vous aider à obtenir un aspect chromé parfait. Profitez de notre expérience et obtenez un résultat convaincant !
Le chromage peut être appliqué sur des métaux tels que : l'acier, l'acier inoxydable, le bronze, le fer, le laiton, le cuivre et le zinc moulé sous pression. La surface chromée est appliquée sur une sous-couche épaisse de nickel. Il s'agit d'une finition durable et robuste, peu sensible à l'usure et aux rayures.
1. Introduction au chromage électrolytique
Si tu t'intéresses au chromage électrolytique, tu es au bon endroit ! Le chromage électrolytique est un procédé qui consiste à appliquer une fine couche de chrome sur un métal. Ce procédé est particulièrement apprécié pour sa durabilité et sa résistance. De plus, la finition chromée est tout simplement superbe et confère à chaque pièce un petit quelque chose en plus. Mais comment fonctionne le chromage électrolytique ? La pièce est d'abord plongée dans un bain d'électrolyte chromé et traversée par un courant. Le chrome est ainsi transféré de l'électrolyte à la pièce et forme une couche de chrome. Pour obtenir un résultat parfait, tu dois toutefois respecter quelques conseils et astuces importants. Par exemple, il est indispensable de bien nettoyer la pièce avant de la chromer. Le choix du bon courant et la durée du chromage jouent également un rôle décisif. Grâce à ces informations de base, tu es parfaitement équipé pour transformer ta pièce en une pièce maîtresse étincelante.
2. Les principaux outils et matériaux
Pour obtenir une finition chromée parfaite, tu as besoin des bons outils et matériaux. Voici les principaux éléments dont tu as besoin : tout d'abord, tu as besoin d'un équipement de galvanisation qui se compose d'une source de courant, d'un électrolyte de chrome et d'une anode. Tu as également besoin d'une surface appropriée que tu veux chromer. Celle-ci doit être propre et exempte de rouille, de saleté et de graisse. Pour ce faire, tu peux utiliser du papier abrasif, de la laine d'acier ou une brosse métallique. Tu auras également besoin de lunettes de protection, de gants et d'un masque respiratoire pour te protéger des vapeurs chimiques. Avec ces outils et ce matériel, tu es prêt à créer ta propre finition chromée.
3. Préparation de la surface pour la finition chromée
Avant de passer au chromage proprement dit, une préparation minutieuse de la surface est indispensable. En effet, seule une surface propre et lisse permet à la finition chromée d'adhérer parfaitement et de déployer tout son effet. Tu dois tout d'abord nettoyer soigneusement la surface à chromer et la débarrasser de la poussière, de la saleté et de la graisse. Pour cela, il est préférable d'utiliser un nettoyant spécial pour métaux ou un liquide vaisselle doux. Ensuite, tu dois travailler la surface avec du papier abrasif fin ou une brosse métallique pour éliminer les irrégularités et les traces de rouille. Veille à ne pas enlever trop de matière et à ne pas endommager la surface. Enfin, il convient de nettoyer et de laisser sécher la surface à fond avant de procéder au chromage proprement dit. En préparant soigneusement la surface, tu poses la première pierre d'une finition chromée parfaite et tu pourras bientôt te réjouir d'un résultat brillant.
4. Application du chromage électrolytique
Lorsqu'il s'agit de chromer des objets, le processus d'électrodéposition est l'une des meilleures options. Il est relativement simple à mettre en œuvre et donne un résultat parfait. Toutefois, l'application du chromage électrolytique nécessite quelques étapes importantes afin de s'assurer que la finition chromée est uniforme et durable. Tout d'abord, la surface de l'objet doit être soigneusement nettoyée pour s'assurer qu'il n'y a pas de particules de saleté ou de résidus de graisse qui pourraient affecter la finition chromée. Ensuite, l'objet doit être plongé dans un bain contenant une solution spéciale de chrome afin de créer une couche de chrome sur la surface. Il est important que l'objet soit constamment déplacé tout au long du processus afin de s'assurer que la couche est appliquée de manière uniforme. Une fois la couche de chrome appliquée, l'objet doit être soigneusement rincé et séché afin d'obtenir une finition chromée parfaite. Si tu suis ces étapes à la lettre, tu seras en mesure d'appliquer une couche de chrome parfaite sur n'importe quel objet et de donner l'impression qu'il sort tout droit d'un atelier professionnel.
5. Finition de la surface pour obtenir une finition parfaite
Après avoir réussi le processus de chromage électrolytique, il est important de préparer soigneusement la surface afin d'obtenir une finition parfaite. Tout d'abord, tu dois éliminer toutes les impuretés de la surface, comme les empreintes digitales ou les particules de poussière. Pour ce faire, tu peux utiliser un chiffon doux ou un chiffon en microfibres. Ensuite, tu dois polir la surface avec un produit de nettoyage spécial pour le chrome. Celui-ci élimine non seulement les éventuels résidus, mais protège également la surface contre la corrosion et l'oxydation. Pour finir, tu peux encore traiter la surface avec une cire ou une vitrification afin de la protéger contre les rayures et les dommages. Grâce à cette finition, tu obtiendras une finition chromée parfaite qui durera longtemps et qui donnera la touche finale à ta pièce.
6. Conseils et astuces pour un résultat professionnel
Pour obtenir un résultat professionnel lors du chromage électrolytique, il existe quelques conseils et astuces dont tu dois tenir compte. Tout d'abord, il est important que tu suives toutes les étapes à la lettre et que tu ne prennes aucun raccourci. Le bon équipement est également essentiel pour obtenir une finition chromée parfaite. Veille à utiliser des matériaux de qualité et à investir dans une bonne source d'énergie. Un nettoyage minutieux de l'objet à chromer est également indispensable pour garantir un revêtement uniforme. En outre, tu dois veiller à ce que la surface de l'objet soit exempte de rayures et d'aspérités. Une bonne préparation et un travail minutieux sont donc essentiels pour obtenir un résultat professionnel lors du chromage électrolytique.
7. Conclusion : DIY deluxe - avec le bon savoir-faire pour une finition chromée parfaite
Et voilà, le résultat est à la hauteur de tes attentes : Ta pièce chromée par tes soins brille d'un nouvel éclat et est prête à être utilisée. Avec le bon savoir-faire et un peu de patience, le chromage galvanique n'est pas un problème, même pour les bricoleurs amateurs. L'important est que tu respectes les consignes de sécurité et que tu exécutes soigneusement les différentes étapes. Avec le bon équipement et quelques trucs et astuces, tu peux donner à tes projets DIY une finition noble et de qualité. Alors, qu'est-ce que tu attends encore ? Essaie et donne à tes pièces un look chromé parfait !
- Cuivre électrolyte alcalin/basique - Domaines d'application
-
Si du fer ou des matériaux sensibles aux acides tels que le plomb, le zinc, le cuivre ou l'acier doivent être cuivrés par électrolyse, l'utilisation de "Cuivre électrolyte alcalin" s'impose pour la préparation. Par exemple, le zinc se dissoudrait dans un électrolyte acide sans traitement préalable avec le "Cuivre électrolyte alcalin". Pour éviter cela, l'électrolyte alcalin, qui préserve les matériaux, munit les matériaux sensibles aux acides d'une première couche de cuivre et les prépare pour le revêtement final avec "Electrolyte de cuivre brillant acide".
Un autre effet positif est l'excellente adhérence de la couche obtenue grâce à "l'électrolyte de cuivre alcalin" ainsi que la protection améliorée contre la corrosion. Le Cuivre électrolyte alcalin de Dr. Galva se caractérise par un dépôt à grains particulièrement fins et est ductile.
- Quelle est la différence entre un électrolyte de cuivre alcalin et un électrolyte acide?
-
En galvanisation, il existe deux principaux types d'électrolytes de cuivre : alcalins et acides. Ils diffèrent par leur composition, leur pH et les propriétés des couches de cuivre déposées.
Différences entre les électrolytes de cuivre alcalins et acides :
pH :
- Électrolyte de cuivre alcalin : Possède un pH élevé (basique), souvent à base de sels comme le cyanure de cuivre ou le sulfate de cuivre, avec des agents complexants ajoutés pour la stabilisation.
- Électrolyte de cuivre acide : A un pH bas (acide) et est généralement à base de sulfate de cuivre et d'acide sulfurique.
Propriétés de dépôt :
- Électrolyte de cuivre alcalin : Convient pour le revêtement des matériaux sensibles aux acides tels que le zinc ou le fer. Il offre une bonne adhérence à ces matériaux et crée une couche souvent plus ductile, c'est-à-dire qu'elle peut être déformée sans se rompre.
- Électrolyte de cuivre acide : Convient pour des couches lisses et décoratives avec une surface brillante. Il est souvent utilisé pour des pièces métalliques de grande taille et simples, et offre un dépôt plus rapide et une structure cristalline plus fine.
Utilisation et application :
- Électrolyte de cuivre alcalin : Est couramment utilisé pour des pièces aux formes complexes et pour un dépôt uniforme sur différents substrats, en particulier lorsque la bonne adhérence et la ductilité sont importantes. Il est souvent utilisé en électronique, pour des circuits imprimés et pour le cuivrage du fer.
- Électrolyte de cuivre acide : Idéal pour les applications nécessitant une surface brillante et décorative, il est souvent utilisé pour les revêtements décoratifs sur des métaux, par exemple dans l'industrie de la bijouterie ou comme base pour les surfaces chromées.
- Je souhaite cuivrer de l'acier ; dois-je choisir acide ou alcalin ?
-
Pour le cuivrage des pièces en acier, il convient de choisir l'électrolyte de cuivre alcalin. Lors de l'utilisation d'un électrolyte de cuivre acide, il peut se produire une déposition chimique (sans courant) de cuivre sur l'acier. Cette réaction chimique incontrôlée conduit à une couche de cuivre à gros grains avec une mauvaise adhérence, ce qui altère la qualité du revêtement.
L'électrolyte alcalin permet une déposition électrolytique contrôlée du cuivre, aboutissant à une couche uniforme et fermement adhérente. Cependant, les électrolytes alcalins ne déposent malheureusement pas une couche brillante, c'est pourquoi on effectue souvent ensuite un cuivrage supplémentaire avec un électrolyte de cuivre acide brillant pour obtenir une surface décorative et brillante. Il est donc courant d'utiliser d'abord l'électrolyte de cuivre alcalin sur les composants en acier pour une bonne adhérence, puis un électrolyte de cuivre acide pour la finition brillante.
- Pourquoi un électrolyte de cuivre acide n'est-il que partiellement adapté au fer ?
-
Le cuivre peut se déposer sur le fer sans courant en raison du potentiel électrochimique, car le cuivre est plus noble que le fer. Lors de cette déposition sans courant, le fer s'oxyde dans la solution acide, ce qui réduit les ions cuivre et les dépose sur la surface du fer.
Cependant, cette déposition sans courant entraîne une mauvaise adhérence du cuivre, car des cristaux de cuivre grossiers se forment, affaiblissant la liaison entre le cuivre et le fer.
Pour atténuer ces problèmes, on peut immerger la pièce dans la solution sous tension, ce qui provoque une déposition électrolytique du cuivre. La tension appliquée permet une déposition contrôlée, améliorant ainsi l'adhérence du cuivre. De cette manière, les problèmes liés à la déposition sans courant peuvent être largement évités.
Pour éviter ce problème, une fine couche d'électrolyte de cuivre alcalin peut être appliquée.
- Quelle est la procédure pour un cuivrage alcalin suivi d’un cuivrage brillant ?
-
1. Préparation de la pièce
- Dégraissage : Chimique ou électrolytique, jusqu’à ce que la surface soit totalement exempte de graisse.
- Décapage : Conditionneur pour enlever les oxydes.
- Rinçage : Rincer soigneusement à l’eau déminéralisée ou du robinet afin d’éviter que des résidus acides ne passent dans le bain de cuivre.
2. Dépôt dans le bain de cuivre alcalin
- But : Fine couche d’adhérence sur le matériau de base.
- Conditions :
Épaisseur de couche seulement 1-3 µm (pas plus épaisse, sinon risque accru de décollement). - Maintenir une densité de courant uniforme, mieux vaut commencer un peu plus bas.
- Conditions :
- Rinçage : Rincer soigneusement immédiatement après le processus.
3. Dépôt dans le bain de cuivre brillant acide
- Transition : Après rinçage, transférer la pièce dans le bain de cuivre brillant.
- Alimentation en courant :
- Commencer d’abord avec une faible densité de courant afin que la couche se dépose finement et adhère bien.
- Puis augmenter lentement jusqu’à la densité de courant de travail normale.
- Épaisseur de couche : Peut être augmentée selon le besoin, décoratif ou fonctionnel.
Erreurs :
Couche de cuivre alcalin trop épaisse : Le but est uniquement de former une fine couche barrière adhérente. Une couche trop épaisse peut créer des tensions et s’écailler par la suite.
Mauvais paramètres du bain : Densité de courant ou tension trop élevées au démarrage dans le cuivre brillant - la surface pas encore parfaitement conductrice développe des „brûlures“ ou une structure cristalline perturbée qui se détache.
- Que fait Nickel-Strike ?
-
Le nickel strike est une couche intermédiaire de liaison en nickel, très fine et fortement acide. Il active les surfaces passives ou difficiles à revêtir et assure une adhérence nettement améliorée des couches suivantes.
À quoi ça sert ?
- Acier inoxydable (V2A/V4A, aciers fortement alliés) : enlève/passive la couche d’oxyde de chrome et rend la surface « active ».
- Pièces déjà nickelées / ancien nickel : réactive les surfaces de nickel anciennes ou ternies.
- Après déchromage : active le nickel sous-jacent pour le revêtement suivant.
Non adapté / mieux : Aluminium → activateur d’aluminium (zincate) ; zinc/zamak → cuivre alcalin d’abord ; acier doux → le conditionneur suffit généralement.
Comment ça marche ?
- Électrolyte de nickel fortement acide et contenant du chlorure, utilisé brièvement à densité de courant relativement élevée.
- Dissout les oxydes et crée une couche de germination en nickel très fine et rugueuse (dixièmes de µm).
- Cette couche de base assure une excellente adhérence pour le nickel principal, éventuellement le cuivre – et donc aussi pour le chrome (chrome uniquement sur nickel).
Conseils pratiques
- Séquence : dégraisser soigneusement → rincer → nickel strike → passer immédiatement, humide, dans le nickel principal.
- Ne pas prolonger : un strike trop long peut fragiliser la couche / favoriser le décollement.
- Entretien du bain : garder la solution propre/fraîche ; densité de courant trop basse = activation insuffisante.
À retenir : Chrome uniquement sur nickel – le nickel strike rend les surfaces difficiles « prêtes pour le nickel ».
- Comment revêtir du nickel terni ?
-
Le nickel terni a été exposé à l'oxygène pendant une longue période. Il en résulte la formation d'oxydes que vous pouvez éliminer avec notre Nickel-Strike tout en créant une couche de nickel solide. Ensuite, vous effectuez le revêtement souhaité.
Un traitement préalable avec Nickel-Strike n'est pas nécessaire si la couche de nickel a été appliquée juste avant le revêtement suivant. Une nouvelle couche de nickel doit être appliquée dans l'heure qui suit, car la couche d'oxyde se forme lentement.
- Que signifie Free-Nickel ? Est-ce que c'est sans nickel ?
-
Non, l'électrolyte de nickel Free-Nickel n'est pas exempt de nickel. Le nom « Free-Nickel » fait référence au fait que cet électrolyte peut être vendu librement, car il répond aux exigences légales pour la vente aux particuliers. De nombreux électrolytes de nickel traditionnels sont soumis à des restrictions strictes dans l'UE et ne peuvent pas être vendus par correspondance.
En revanche, notre électrolyte de nickel libre a été spécialement conçu pour répondre à ces exigences et peut donc être acheté en ligne sans aucune restriction. Veuillez noter qu'il s'agit néanmoins d'un électrolyte de nickel qui sépare le nickel et qui contient donc du nickel.
- Comment faire du nickelage : Tutoriel de bricolage simple
-
Le nickelage galvanique est une méthode simple et peu coûteuse pour protéger rapidement et efficacement les pièces métalliques. Dans notre tutoriel DIY, vous apprendrez tout ce que vous devez savoir pour nickeler vous-même vos pièces métalliques. Apprenez à protéger et à prêter vos projets rapidement et efficacement ! Il n'y a rien de mieux que la satisfaction d'avoir mené à bien un projet personnel. Alors, qu'attendez-vous ? C'est parti !
1. Pourquoi le nickelage électrolytique ?
Si tu te demandes pourquoi le nickelage électrolytique est une bonne option, il y a plusieurs raisons. D'une part, le procédé offre une grande résistance à la corrosion, ce qui signifie que l'objet nickelé dure plus longtemps et est moins sujet à la rouille et à d'autres dommages similaires. En outre, le procédé confère à l'objet une surface brillante et uniforme, qui est non seulement esthétique, mais offre également une meilleure conductivité. Le nickelage électrolytique peut également contribuer à rendre l'objet plus résistant à l'usure et à l'abrasion, ce qui est particulièrement utile lorsqu'il est régulièrement sollicité. Dans l'ensemble, le nickelage électrolytique offre une multitude d'avantages qui en font une option attrayante pour ceux qui souhaitent protéger et améliorer leurs objets.
2. Qu'est-ce que la galvanisation et comment fonctionne-t-elle ?
La galvanisation est un processus par lequel une couche de métal est appliquée sur un autre matériau. Il s'agit d'une méthode courante pour protéger les pièces métalliques ou leur donner un aspect décoratif. Le processus de galvanisation se fait par électrolyse, où un courant électrique est conduit à travers une solution contenant le métal à appliquer sur le matériau à revêtir. Le matériau à revêtir est appelé cathode, tandis que le métal à appliquer est appelé anode. Lorsque le courant circule dans la solution, des ions métalliques sont libérés par l'anode et déposés sur la cathode, ce qui crée une couche métallique permanente. L'épaisseur de la couche dépend de la durée du processus. La galvanisation peut être utilisée pour une grande variété de matériaux tels que l'acier, le cuivre, le laiton et l'aluminium. C'est une méthode économique et simple pour protéger des pièces métalliques ou leur donner un aspect décoratif.
3. Quels sont les outils nécessaires pour un projet DIY ?
Si tu souhaites réaliser un projet DIY, il est important d'avoir les bons outils à portée de main. Pour le nickelage galvanique, tu as besoin de quelques outils spéciaux qui t'aideront à mener à bien le projet. Tout d'abord, tu as besoin d'une source d'énergie comme une batterie ou un adaptateur secteur. Tu as également besoin d'un électrolyte qui dépose le nickel sur le métal. Une anode en nickel et un matériau cathodique sont également nécessaires. Enfin, tu as besoin d'un produit de nettoyage approprié pour nettoyer le métal avant le nickelage. Un papier abrasif ou une brosse métallique peuvent également être utiles pour préparer le métal. N'oublie pas de porter des gants et des lunettes de protection pour te protéger des blessures. Avec ces outils et un peu de pratique, tu peux réussir ton projet DIY de nickelage galvanique.
4. Instructions pas à pas pour le nickelage électrolytique
Pour réaliser un nickelage électrolytique, tu as besoin de quelques matériaux et outils spéciaux. Tout d'abord, tu dois nettoyer et dégraisser soigneusement les pièces à nickeler afin de t'assurer que le revêtement de nickel adhère bien. Ensuite, tu dois préparer une solution de bain de nickel et la placer dans un récipient approprié. Ensuite, tu dois brancher une source de courant et plonger les pièces à nickeler dans la solution en tant que cathode. La tige d'anode doit être immergée dans la solution, mais ne doit pas entrer en contact avec les pièces à nickeler. Pendant le processus, tu dois surveiller le courant et le temps pour t'assurer que l'épaisseur souhaitée du revêtement de nickel est atteinte. Une fois le processus terminé, les pièces doivent être soigneusement rincées et séchées. Il est important de respecter toutes les mesures de sécurité et de porter un équipement de protection approprié afin d'éviter les blessures. Grâce à ces instructions étape par étape, tu peux maintenant réussir à fabriquer tes propres pièces nickelées par électrolyse.
5. Conseils et astuces pour obtenir le meilleur résultat possible
Pour obtenir le meilleur résultat possible lors du nickelage électrolytique, il existe quelques conseils et astuces dont tu dois tenir compte. Tout d'abord, il est important que tu prépares tous les matériaux et outils nécessaires avant de commencer le processus. Une préparation minutieuse est la clé du succès. Tu dois également veiller à ce que la surface à nickeler soit parfaitement nettoyée et dégraissée afin de garantir une adhérence optimale du revêtement de nickel. Une alimentation électrique régulière et une durée raisonnable du bain galvanique sont également essentielles pour obtenir un résultat parfait. Si tu suis ces conseils et astuces, tu obtiendras à coup sûr un résultat formidable et tu feras passer tes projets DIY à un niveau supérieur.
6. Application du nickelage galvanique
Si tu te demandes à quoi sert le nickelage électrolytique, tu es au bon endroit. Le nickelage électrolytique est une méthode qui permet de recouvrir les objets métalliques d'une fine couche de nickel. Cette couche protège le métal contre la corrosion et lui confère une surface brillante. Le nickelage électrolytique est utilisé dans de nombreux domaines, comme l'industrie électronique, l'industrie automobile et la bijouterie. Il s'agit d'une méthode économique pour ennoblir les objets métalliques et les protéger contre les influences extérieures. Grâce à notre tutoriel DIY, tu peux facilement réaliser le nickelage galvanique chez toi et affiner tes propres objets métalliques.
7. Choses importantes à prendre en compte lors du nickelage électrolytique
Si tu as décidé de faire du nickelage électrolytique, il y a quelques choses importantes dont tu dois tenir compte pour obtenir un résultat optimal. Tout d'abord, il est important que l'objet à nickeler soit propre et exempt d'huile, de graisse et d'autres impuretés. Un nettoyage minutieux avec un produit de nettoyage approprié est donc indispensable. En outre, tu dois veiller à ce que l'intensité du courant et la durée du processus de nickelage soient adaptées au matériau et à la taille de l'objet à nickeler. Une intensité de courant trop élevée ou une durée de galvanisation trop longue peuvent donner des résultats indésirables. Enfin, tu dois également veiller à respecter toutes les mesures de sécurité nécessaires afin d'éviter les blessures ou les dommages. Avec ces conseils importants et un peu de pratique, tu peux toutefois réussir le nickelage électrolytique et doter tes objets d'une couche de nickel durable et attrayante.
8. Quels sont les avantages et les inconvénients du nickelage électrolytique ?
Si tu décides de faire du nickelage électrolytique, il y a quelques avantages et inconvénients dont tu dois tenir compte. Le principal avantage est la fonction de protection qu'offre le nickelage. Grâce au nickelage galvanique, le métal de base est protégé contre la corrosion et l'usure. De plus, le nickelage peut améliorer l'apparence de l'objet et lui donner un aspect brillant. Toutefois, il présente également quelques inconvénients. D'une part, le nickelage peut être coûteux, surtout s'il est réalisé par un professionnel. D'autre part, il peut être difficile d'appliquer une couche uniforme, ce qui peut donner des résultats inégaux. En outre, le nickelage peut provoquer des réactions allergiques si l'objet entre en contact avec la peau. Malgré cela, le nickelage galvanique est une méthode populaire pour protéger et embellir les objets métalliques.
9. Quels peuvent être les coûts d'un projet DIY ?
Si tu décides de faire du nickelage électrolytique, tu dois être conscient que cela peut engendrer quelques coûts. Tout d'abord, tu as besoin d'une source de courant appropriée, comme un bloc d'alimentation qui peut être réglé sur la tension et l'intensité nécessaires. Tu auras également besoin d'une solution électrolytique de nickel, dont le prix varie en fonction de la taille de l'objet à nickeler. Il faut également tenir compte des accessoires tels que les anodes, les cathodes et les câbles de connexion. En outre, tu auras besoin de vêtements de protection appropriés pour te protéger des produits chimiques. Si tu achètes toi-même tout l'équipement, cela peut vite devenir cher. Cependant, il est également possible d'emprunter l'équipement ou de le louer dans un magasin de bricolage. Il est important que tu réfléchisses à l'avance si le coût du projet DIY en vaut la peine et si tu utiliseras l'équipement à l'avenir.
10. Conclusion : le nickelage galvanique, un moyen efficace de protéger les surfaces métalliques
Lorsqu'il s'agit de protéger le métal, le nickelage électrolytique est une méthode extrêmement efficace. En appliquant une fine couche de nickel sur la surface métallique, celle-ci est protégée contre la corrosion et l'abrasion. En outre, le nickelage confère au métal un aspect brillant et attrayant. Mieux encore, tu peux facilement réaliser toi-même le nickelage galvanique. Avec quelques outils et matériaux de base, tu peux nickeler tes propres pièces métalliques et leur donner ainsi une durée de vie plus longue et un meilleur aspect. Que tu sois un bricoleur amateur ou un artisan professionnel, le nickelage électrolytique est définitivement une compétence qui vaut la peine d'être apprise.
- Le nickel peut-il être déposé directement sur du laiton ?
-
Oui. Le nickel peut être déposé électrolytiquement directement sur le laiton. Pour un démarrage sûr, utilisez un court strike (flash) nickel (acide, riche en chlorures) comme sous-couche, puis construisez en nickel.
Séquence de procédé recommandée
- Dégraissage, rinçage soigné.
- Micro-décapage pour alliages Cu/Zn (très court), rinçage.
- Activation acide (conditionneur), enchaîner humide-sur-humide.
- Strike nickel, départ à faible densité de courant, 20–90 s.
- puis nickel.
Remarques
- Éviter la dézincification : garder des temps de décapage/activation courts ; pas de phases de séchage.
- Paramètres de départ : commencer à faible densité de courant, monter rapidement à la consigne ; un niveau modéré de chlorures améliore l’adhérence.
- Contre le jaunissement : prévoir une épaisseur totale de Ni suffisante.
Défauts typiques & remèdes
- Cloques/décollage : décapage trop long, surface sale, courant initial trop élevé → raccourcir les temps, réactiver, démarrer à faible densité de courant.
- Démarrage gris foncé/passivation : éviter les attentes, renouveler l’activation.
- Rugosité : améliorer la filtration/la qualité des rinçages, éliminer les sources de particules.
- Faut-il procéder à une passivation après la zingage ?
-
La nécessité d’une passivation après la galvanisation dépend de l’usage prévu et des exigences spécifiques.
Pas toujours indispensable
Pour de nombreuses applications standard, une simple couche de zinc (par exemple, par galvanisation à chaud ou électrolytique) suffit à assurer une protection de base contre la corrosion. En particulier pour les pièces qui ne sont pas soumises à des exigences esthétiques ou de résistance à la corrosion élevées, la passivation est souvent omise.
Avantages de la passivation
- Protection anticorrosion supplémentaire : Les passivations (par exemple, chromatation de différentes couleurs, phosphatation, etc.) créent une couche protectrice supplémentaire qui empêche l’oxydation du zinc sous-jacent et prolonge sa durée de vie.
- Amélioration esthétique : Les surfaces passivées peuvent être visuellement améliorées selon le procédé utilisé (bleu, jaune, noir, etc.).
- Réduction de la rouille blanche : Les surfaces fraîchement galvanisées peuvent développer une rouille blanche lorsqu'elles sont exposées à l’humidité ou à la condensation. Une passivation réduit ce risque.
Exigences spécifiques
Pour les pièces exposées à des conditions environnementales extrêmes (par exemple, brouillard salin, forte humidité ou produits chimiques agressifs) ou nécessitant un aspect visuel défini (comme dans l’industrie automobile ou pour des applications décoratives), une passivation ou une chromatation est généralement recommandée, voire obligatoire.
Conclusion
La passivation après la galvanisation n’est pas toujours obligatoire, mais elle présente des avantages notables en termes de protection contre la corrosion et d’esthétique. Son utilité dépend des conditions d’utilisation et des exigences de qualité spécifiques.
- Chromatation jaune - zingage jaune
-
Le chromatage jaune (également appelé familièrement "zingage jaune") est un procédé de galvanoplastie dans lequel des surfaces déjà zinguées subissent une passivation jaune. Ce traitement chimique confère une surface caractéristique jaune à dorée, qui est à la fois esthétique et protectrice contre la corrosion.
Comment fonctionne le chromatage jaune ?
-
Couche de zinc comme base
Tout d'abord, le métal (par exemple, l'acier) est zingué, soit par zingage électrolytique, soit par zingage à chaud. Cette couche de zinc sert de base au processus de chromatage.
-
Traitement chimique
Ensuite, une passivation ou un chromatage est appliqué. Dans la variante jaune, une solution spéciale de chromate produit la teinte jaune à dorée.- Autrefois, le chrome(VI) était souvent utilisé, mais il est désormais strictement réglementé.
- Les systèmes modernes sont de plus en plus basés sur le chrome(III) afin de respecter les réglementations environnementales et sanitaires.
-
Développement de la couleur
La surface de zinc réagit avec les composants de la solution de chromate pour former une couche de conversion ("couche de chromate"). Cette couche renforce la protection contre la corrosion et donne la couleur jaune dorée caractéristique.
Pourquoi utiliser le chromatage jaune ?
- Amélioration esthétique : La surface jaune/dorée est décorative et très prisée dans de nombreux secteurs, notamment pour les ferrures, les vis et les pièces décoratives.
- Protection anticorrosion supplémentaire : La couche de chromate protège encore plus le zinc sous-jacent contre l’oxydation.
- Norme éprouvée : Les pièces chromatées en jaune sont reconnues depuis des décennies comme une référence en matière de surfaces résistantes à la corrosion et esthétiques.
Chrome(VI) vs. Chrome(III)
- Chrome(VI) : Anciennes méthodes largement utilisées. Offrait une coloration jaune intense mais est aujourd’hui strictement réglementé ou interdit en raison de son impact environnemental et sanitaire.
- Chrome(III) : Alternative plus respectueuse de l’environnement et de la santé. L’intensité de la couleur peut être légèrement moins prononcée, mais ces procédés respectent les réglementations actuelles et évoluent constamment.
Avantages et limites du chromatage jaune
Avantages
- Aspect jaune/doré distinctif
- Protection anticorrosion améliorée par rapport au simple zingage
- Large éventail d’applications, notamment dans l’industrie automobile, l’électronique et l’usage domestique
Inconvénients
- Réglementation stricte sur les procédés contenant du chrome(VI)
- Limité aux teintes jaunes/dorées
- Qualité fortement dépendante de la préparation et de la composition de la couche de zinc
Conclusion
Le chromatage jaune est un traitement post-zingage qui génère une couche de chromate jaune ou dorée. Cette couche renforce la protection contre la corrosion et donne un aspect esthétique distinctif. Autrefois principalement réalisé avec des solutions contenant du chrome(VI), ce procédé utilise aujourd’hui de plus en plus des systèmes à base de chrome(III) pour répondre aux exigences environnementales et sanitaires. Malgré quelques différences en termes d’intensité de couleur ou de processus, les surfaces chromatées jaunes restent parmi les finitions les plus populaires et les plus courantes en galvanoplastie.
-
Couche de zinc comme base
- Chromatage noir - Zingage noir
-
Le chromatage noir (également appelé zincage noir dans le langage courant) est un procédé de galvanoplastie dans lequel une surface déjà galvanisée est traitée avec une passivation foncée. Ce traitement chimique crée une couche de chromate noir profond ou anthracite, qui améliore à la fois la protection contre la corrosion et offre une esthétique sombre et distinctive.
Comment fonctionne le chromatage noir ?
-
Couche de zinc comme base
Tout d'abord, le métal (par exemple, l'acier) est galvanisé (par électrolyse ou galvanisation à chaud) afin de former une couche de zinc servant de protection de base.
-
Passivation foncée
Après la galvanisation, une passivation/chromatation est appliquée avec une solution spéciale qui crée une coloration noire. Traditionnellement, des solutions contenant du chrome(VI) étaient utilisées, mais elles sont désormais fortement réglementées pour des raisons sanitaires et environnementales. Aujourd’hui, des procédés à base de chrome(III) ou d'autres alternatives sans chrome(VI) sont de plus en plus courants et offrent une surface très sombre.
-
Réaction et formation de la couche
Dans la solution de passivation, la couche de zinc existante réagit avec certains produits chimiques. Une couche de conversion (chromate) est alors formée, qui est colorée en noir et offre une protection supplémentaire contre la corrosion.
Avantages et domaines d'application
- Aspect visuel distinctif : La finition noire est appréciée pour des raisons esthétiques ou de camouflage (par exemple, dans les applications militaires).
- Protection anticorrosion améliorée : La couche de chromate protège le zinc sous-jacent contre l'oxydation et prolonge ainsi la durée de vie du revêtement.
- Nombreuses applications : Le chromatage noir est utilisé dans l’industrie automobile, la fixation de vis et boulons, l’électronique, le bricolage et les applications décoratives.
Procédés avec chrome(VI) vs. sans chrome(VI)
- Procédés avec chrome(VI) : Offrent une coloration noire intense, mais sont fortement réglementés ou interdits pour des raisons environnementales et sanitaires (ex. réglementation REACH).
- Procédés sans chrome(VI) / à base de chrome(III) : Offrent une coloration sombre, sont plus respectueux de l’environnement et de la santé et continuent d’être développés pour rivaliser avec les anciens procédés en termes d’intensité de couleur et de protection contre la corrosion.
Limites du chromatage noir
- Sensibilité aux contraintes mécaniques : Les frottements et les rayures peuvent user la couche de chromate noire.
- Précision du processus : Pour obtenir un noir uniforme, les paramètres du bain (température, temps, composition chimique) doivent être rigoureusement respectés.
- Dépendance à la qualité du zinc : Une bonne préparation de la couche de zinc est essentielle, car la teinte noire n’adhère bien que si le zinc est propre et uniformément déposé.
Conclusion
Le chromatage noir, souvent appelé zincage noir, est une technique de passivation foncée des surfaces galvanisées. Elle permet d'obtenir une finition noire profonde ou anthracite tout en améliorant la résistance à la corrosion. Dans sa version sans chrome(VI), le chromatage noir représente aujourd’hui une alternative plus écologique et plus sûre pour obtenir une surface noire esthétique et fonctionnelle.
-
Couche de zinc comme base
- Faire soi-même de l`électrozingage : un guide pour un projet DIY facile !
-
Avis aux amateurs de bricolage : Faire soi-même de l'électrozingage est plus facile que prévu ! Grâce à nos instructions, vous obtiendrez un aperçu détaillé des bases de la galvanisation et des avantages qu'elle apporte. En route pour un projet DIY passionnant !
1. Introduction
Hé, toi ! Tu veux apprendre à galvaniser tes propres pièces métalliques ? Alors tu es au bon endroit ! Dans ce guide, nous te montrons pas à pas comment réaliser ton projet DIY. Mais avant de commencer, nous souhaitons t'expliquer ce qu'est l'électrozingage. Il s'agit d'un procédé qui consiste à appliquer une couche de protection sur le métal afin de le protéger contre la corrosion. Cette couche protectrice est composée de zinc et est appliquée sur le métal par une réaction chimique. Maintenant que tu sais ce qui t'attend, allons-y !
2. Qu'est-ce que l'électrozingage ?
La galvanisation est un processus par lequel une couche de zinc est appliquée sur un métal afin de le protéger contre la corrosion. C'est l'une des méthodes les plus utilisées pour protéger l'acier et le fer contre la rouille. Le processus fonctionne par électrolyse : le métal est plongé dans une solution de zinc et une charge électrique est transmise à travers le métal. Cela a pour effet d'appliquer le zinc de la solution sur le métal, ce qui crée une couche protectrice. L'électrozingage est une méthode peu coûteuse et efficace pour protéger les métaux contre la corrosion et convient également aux projets de bricolage. Avec quelques connaissances et outils de base, tu peux réaliser tes propres projets d'électrozingage à la maison.
3. Faire des préparatifs
Avant de commencer l'électrozingage, tu dois effectuer quelques préparatifs afin de garantir la réussite de ton projet DIY. Tout d'abord, tu dois t'assurer d'avoir tous les matériaux et outils nécessaires à portée de main, comme une anode en zinc, un bain de galvanisation, une source de courant et des gants de protection. Il est également important que tu aménages un poste de travail approprié, bien ventilé et sans matériaux inflammables à proximité. Avant de commencer le processus de galvanisation, tu dois t'assurer que l'objet à galvaniser est bien nettoyé et dégraissé afin de garantir une adhérence optimale de la couche de zinc. N'oublie pas que la sécurité est primordiale et que tu dois toujours porter des gants et des lunettes de protection afin d'éviter les blessures. Avec ces préparatifs, tu es prêt à mener à bien ton projet DIY d'électrozingage.
4. Se procurer les outils et les matériaux pour la galvanisation
Pour mener à bien ton projet DIY de galvanisation, tu as besoin des bons outils et matériaux. Tout d'abord, tu dois choisir une solution de galvanisation appropriée, que tu peux acheter chez nous. Un récipient approprié dans lequel tu peux mélanger le bain de galvanisation et y plonger l'objet à galvaniser est également très important. Un récipient en plastique ou un vieux pot en acier inoxydable conviennent par exemple. Un autre outil important est un redresseur qui régule l'intensité du courant et permet ainsi d'obtenir un résultat de galvanisation uniforme. Tu as également besoin d'une anode, composée de zinc, qui est suspendue dans le bain de galvanisation. Celle-ci sert de source de courant et veille à ce que le zinc se dépose sur l'objet à galvaniser. Pour bien nettoyer l'objet avant la galvanisation, il est recommandé d'utiliser du papier abrasif et des produits de nettoyage comme l'isopropanol. Avec ces outils et ces matériaux, tu es parfaitement équipé pour mener à bien ton projet DIY de zingage électrolytique.
5. Préparer la surface et la graisser
Avant de commencer le processus de galvanisation proprement dit, tu dois t'assurer que la surface de l'objet à galvaniser est lisse et propre. Pour ce faire, tu dois la nettoyer soigneusement et, le cas échéant, enlever la rouille. Ensuite, tu dois rendre la surface légèrement rugueuse à l'aide d'une brosse métallique ou de papier abrasif afin de garantir une meilleure adhérence de la couche de zinc. Pour obtenir un résultat optimal, il est également conseillé de traiter la surface avec une graisse ou une huile appropriée avant la galvanisation. Cela empêche le zinc d'adhérer à des endroits indésirables et évite la formation de gouttes inesthétiques ou de couches irrégulières. Veille à n'utiliser que des graisses ou des huiles spéciales adaptées au processus de galvanisation. Avec une préparation minutieuse de la surface et un traitement soigneux avec de la graisse ou de l'huile, plus rien ne s'oppose à la réussite de ton projet DIY.
6. Réaliser l'électrozingage
Avant de commencer l'électrozingage, tu dois t'assurer d'avoir tous les matériaux et outils nécessaires sous la main. Il s'agit entre autres d'un kit d'anodes en zinc, d'une alimentation en courant continu, d'un récipient en plastique, d'un électrolyte de zinc et de gants pour se protéger des produits chimiques. Tout d'abord, tu dois nettoyer et dégraisser soigneusement l'objet à galvaniser afin de garantir une adhérence optimale de la couche de zinc. Ensuite, l'objet est connecté à l'alimentation en courant continu en tant que cathode et plongé dans l'électrolyte de zinc. L'anode de zinc sert d'anode et libère des ions de zinc qui se déposent sur l'objet et forment une couche protectrice. Plus l'objet reste longtemps dans l'électrolyte, plus la couche de zinc s'épaissit. Après la galvanisation, l'objet doit être soigneusement rincé et séché. Avec un peu de pratique et de patience, tu peux ainsi réaliser un zingage professionnel chez toi.
7. Traitement ultérieur des pièces après la galvanisation
Après avoir galvanisé tes pièces avec succès, il est important de les traiter correctement afin de garantir leur durabilité et leur esthétique. Tout d'abord, tu dois rincer soigneusement les pièces à l'eau afin d'éliminer l'excédent de zinc. Ensuite, tu peux les nettoyer avec un détergent doux et un chiffon doux pour enlever les éventuels résidus de saleté. Ensuite, tu dois laisser sécher les pièces avant de les protéger avec une couche de vernis. Un spray spécial ou une vitrification à base de cire ou d'huile conviennent à cet effet. La couche de protection protège les pièces de la corrosion et leur confère un aspect brillant. Note toutefois que le traitement ultérieur peut varier en fonction du type de pièces et de la galvanisation. Renseigne-toi donc au préalable sur les étapes recommandées pour ton projet spécifique.
8. Éviter les erreurs lors de l'auto-galvanisation
Si tu décides d'embellir ton projet DIY avec une galvanisation, tu dois éviter certaines erreurs pour obtenir le meilleur résultat possible. Une erreur fréquente est de ne pas nettoyer suffisamment l'objet à galvaniser. Il est important d'éliminer tous les résidus de graisse et d'huile, car ils peuvent nuire à l'adhérence de la couche de zinc. L'élimination de la rouille et des autres impuretés est également une étape importante pour obtenir une couche de zinc uniforme et durable. Une autre erreur est de ne pas préparer suffisamment la solution électrolytique. Il est important d'utiliser les bonnes quantités d'acide zincique et d'acide chlorhydrique pour garantir une conductivité optimale. Il est également essentiel de choisir le bon courant pour obtenir une couche de zinc uniforme. Si tu évites ces erreurs, tu peux être sûr que ton projet DIY de zingage électrolytique sera une réussite totale.
9. Conclusion : faire soi-même de l'électrozingage - un projet DIY qui en vaut la peine !
Conclusion : Faire soi-même de l'électrozingage - un projet DIY qui en vaut la peine ! En résumé, l'électrozingage est un projet de bricolage qui en vaut la peine. Non seulement c'est moins cher que de faire appel à un prestataire professionnel, mais c'est aussi une excellente façon de se familiariser avec la technique de la galvanisation. Avec un peu de pratique et de patience, même les débutants peuvent rapidement obtenir de bons résultats. Il est toutefois important de prendre les mesures de sécurité nécessaires et de suivre les instructions. Donc, si vous êtes à la recherche d'un nouveau projet DIY et que vous vous intéressez au travail du métal, vous devriez absolument essayer l'électrozingage.
- Comment peut-on revêtir du zinc (y compris le Zamak) ?
-
Revêtement galvanique sur zinc ou zinc moulé sous pression
Si le zinc (par ex. zinc moulé sous pression ou surfaces galvanisées) est déjà présent comme substrat et qu'une couche galvanique supplémentaire (par ex. cuivre, nickel, chrome, etc.) doit être appliquée, des exigences légèrement différentes s'appliquent par rapport à l'acier. Le zinc est un métal relativement réactif et peut être rapidement attaqué par des acides ou alcalis forts. Il a également tendance à former des oxydes, ce qui peut compliquer une bonne adhérence. C'est pourquoi – en particulier pour le zinc moulé sous pression – on utilise généralement un “strike” (couche d'adhérence) afin d'assurer une adhérence fiable pour la couche finale. Un électrolyte de cuivre alcalin est utilisé comme couche d'adhérence (strike).
Voici une séquence de procédé recommandée pour le revêtement galvanique sur zinc ou zinc moulé sous pression :
-
Nettoyage / Dégraissage
But : Élimination des graisses, huiles et autres impuretés.
Remarques : Utiliser des nettoyants adaptés (doux), car le zinc peut être attaqué dans des milieux fortement alcalins. Le plus souvent procédé par bain d'immersion, éventuellement assisté par ultrasons ou nettoyage par pulvérisation. -
Rinçage
But : Éliminer les résidus de nettoyant afin d'éviter la contamination des bains suivants.
Astuce : Un rinçage en plusieurs étapes (eau froide ou chaude) est souvent recommandé pour nettoyer parfaitement la surface. -
Léger décapage / Activation (Conditionneur)
But : Éliminer les fines couches d'oxyde et activer la surface du zinc.
Conditionneur : Bain spécial, légèrement acide, légèrement dilué (selon les instructions du fabricant) pour traiter la surface de zinc en douceur sans l'attaquer excessivement. -
Court rinçage
But : Éliminer les résidus de décapage ou de conditionneur pour éviter la contamination des bains suivants.
-
Couche d'adhérence (électrolyte de cuivre alcalin)
But : Appliquer une couche métallique très fine mais fortement adhérente comme base pour les revêtements suivants.
Électrolyte de cuivre alcalin :
- Fournit une bonne adhérence sur le zinc si la surface est correctement préparée.
- Plus respectueux de l'environnement et plus sûr que les bains contenant du cyanure. -
Revêtement principal
Options :
- Autre couche de cuivre (acide) pour la conductivité et le lissage.
- Nickel pour la protection anticorrosion et la dureté.
- Chrome (après le nickel) pour la brillance et la résistance à l'usure.
- Autres métaux ou alliages (par ex. laiton, étain, bronze) selon les besoins. -
Rinçage / Post-traitement
But : Éliminer les résidus d'électrolyte et les additifs.
Optionnel : Passivation ou scellement pour une protection anticorrosion supplémentaire ou un aspect spécifique. -
Séchage / Contrôle final
Séchage : Centrifugeuse, four à air chaud ou similaire pour éviter les taches d'eau.
Final : Inspection visuelle, mesure de l'épaisseur du revêtement et tests d'adhérence.
Résumé des étapes du procédé
- Dégraissage / Nettoyage
- Rinçage
- Léger décapage / Activation (Conditionneur, dilué)
- Rinçage
- Couche d'adhérence (Électrolyte de cuivre alcalin)
- Revêtement principal (p. ex. cuivre brillant, nickel)
- Rinçage / Post-traitement
- Séchage / Contrôle final
-
- Le bloc d'alimentation n'affiche rien ou n'atteint pas la tension
-
Les blocs d'alimentation régulent le flux de courant par le biais de la tension, cela découle de la loi d'Ohm. Si aucun consommateur n'est connecté, le courant ne peut pas circuler.
Si la limitation de courant est réglée sur zéro, la tension tombera également à 0.
Régler la tension
- Tourne les boutons de réglage grossier et fin de la tension jusqu'à ce que la tension de sortie souhaitée s'affiche à l'écran.
- Veille à ce que la tension réglée ne dépasse pas la tension d'alimentation maximale du consommateur à faire fonctionner.
- Si la tension ne peut pas être augmentée davantage, la limitation de courant est probablement réglée trop bas, augmentez-la.
- Le flux de courant est alors déterminé par la résistance ohmique.
Régler la limitation de courant
- Régler une tension très basse d'environ 1 V- pour éviter la formation d'étincelles et former un court-circuit avec les câbles de mesure raccordés.
- Le bloc d'alimentation passe alors du mode tension constante au mode courant constant (l'écran affiche C.C au lieu de C.V).
- Tourne maintenant les boutons de réglage grossier et fin du courant jusqu'à ce que le courant de sortie souhaité s'affiche à l'écran.
- Une fois que la limitation de courant a été réglée avec succès, le court-circuit peut à nouveau être supprimé.
- Augmente ensuite à nouveau la tension à la valeur souhaitée.
- Si tu travailles avec la limitation de courant, la tension est réduite en fonction de la résistance appliquée
Si aucun courant ne passe, vérifier la connexion.
- Formation de boue noire ou dépôt mat
-
Lorsque de la boue noire se forme lors du processus de galvanisation ou que le revêtement devient mat, cela peut indiquer plusieurs problèmes dans le processus de galvanisation. Voici les causes les plus fréquentes :
Courant excessif (surcharge) :
- Symptôme : Formation de boue noire ou surface mate et irrégulière.
- Cause : Si le courant est trop élevé, les particules de métal peuvent se déposer trop rapidement, entraînant un dépôt grossier, poreux ou même noir. Cela se produit particulièrement lorsque la densité de courant (courant par surface) est trop élevée.
- Solution : Réduisez le courant ou la tension pour obtenir un dépôt métallique plus uniforme et plus lisse (notez cependant que dans certains électrolytes, la couche peut devenir mate si la densité de courant est trop faible).
Mauvais nettoyage de la pièce :
- Symptôme : Revêtement irrégulier et mat ou taches noires.
- Cause : Les contaminants, l'oxydation ou la graisse sur la surface de la pièce peuvent perturber le dépôt métallique et entraîner des défauts dans le revêtement.
- Solution : Nettoyez soigneusement la pièce avant de l'immerger dans le bain d'électrolyte. Éliminez toutes les graisses, couches d'oxydes et saletés par un lavage, ponçage et rinçage minutieux.
Matériau de la pièce inapproprié :
- Symptôme : Boue noire dans l'électrolyte ou revêtement mat.
- Cause : Si le matériau de la pièce n'est pas compatible avec l'électrolyte utilisé, il peut se dissoudre et contaminer l'électrolyte, ce qui entraîne un revêtement de mauvaise qualité et des dépôts indésirables.
- Solution : Assurez-vous que le matériau de la pièce est compatible avec l'électrolyte utilisé. Vérifiez la composition du matériau et choisissez un électrolyte adapté pour éviter les réactions chimiques provoquant des contaminations.
Mauvaise position des électrodes :
- Symptôme : Dépôts noirs dans certaines zones.
- Cause : Une distribution inégale du courant due à une mauvaise position de l'anode ou de la cathode peut entraîner un dépôt excessif de métal à certains endroits, provoquant la formation de boue noire.
- Solution : Assurez-vous que les électrodes sont correctement positionnées et que le courant est uniformément réparti. Vérifiez les distances entre les électrodes et la position de la pièce dans le bain.
Durée excessive de galvanisation :
- Symptôme : Revêtement mat ou foncé.
- Cause : Si la pièce reste trop longtemps dans le bain d'électrolyte, elle peut devenir sursaturée, ce qui entraîne une couche mate ou même noire.
- Solution : Réduisez la durée de galvanisation et surveillez régulièrement le processus pour garantir que l'épaisseur souhaitée est atteinte sans affecter la surface.
Température inadéquate de l'électrolyte :
- Symptôme : Matité ou dépôts noirs.
- Cause : Les écarts de température peuvent modifier la vitesse des réactions chimiques dans l'électrolyte, affectant la qualité du revêtement.
- Solution : Vérifiez et régulez la température de l'électrolyte pour qu'elle reste dans la plage optimale du processus de galvanisation spécifique.
Résumé :
La formation de boue noire ou un revêtement mat lors du processus de galvanisation sont souvent causés par un courant excessif, un nettoyage insuffisant, un matériau de pièce inapproprié, une distribution inégale du courant ou des problèmes de température. L'ajustement de ces paramètres peut améliorer considérablement la qualité du revêtement.
- Le dépôt de chrome devient sombre
-
Il est normal que le chrome paraisse sombre dans les premières phases du dépôt. Cela est dû au fait qu'au début, la couche de chrome est très finement cristallisée, ce qui fait que la lumière est réfléchie différemment et que la surface paraît sombre. Au fur et à mesure que le dépôt progresse, les cristaux s'agrandissent et la couche s'éclaircit progressivement pour prendre la couleur typique du chrome.
Il se peut aussi que la densité de courant soit trop élevée. Une densité de courant trop élevée entraîne un dépôt trop rapide et irrégulier de la couche de chrome, ce qui peut également conduire à une surface sombre ou noire. Une densité de courant plus faible permet une formation plus régulière des cristaux et donc une couche de chrome plus claire et plus uniforme. Il faut ici trouver un compromis entre vitesse et qualité.
Un autre point important est que l'électrolyte est devenu trop chaud en raison de la densité de courant élevée. Une température trop élevée entraîne également une coloration foncée de la couche. Dans ce cas, il faudrait réduire la densité de courant ou interrompre le dépôt.
- Le revêtement sur l'acier inoxydable ne tient pas
-
Si le revêtement n'adhère pas à l'acier inoxydable, la raison en est généralement un traitement préalable insuffisant. Au contact de l'air, l'acier inoxydable forme en quelques secondes une couche d'oxyde invisible qui protège le métal contre les réactions chimiques, mais qui affecte aussi considérablement l'adhérence des revêtements.
Pour garantir un revêtement durable, il est essentiel de préparer la pièce avec un Nickel-Strike. Cet activateur galvanique élimine la couche d'oxyde ainsi que le chrome contenu dans l'alliage d'acier inoxydable et forme une fine couche de nickel adhérente comme base pour le revêtement ultérieur.
Il est également possible d'utiliser un strike d'or (flash d'or) pour obtenir des résultats similaires.
- Le nickel ne se dépose pas sur le fer
-
Il faut être patient, car le nickel se dépose assez lentement. Il se peut que la densité de courant soit trop faible, auquel cas cela prendrait beaucoup plus de temps. Il ne faut pas non plus qu'il y ait trop de bulles de gaz, sinon des bandes noires pourraient apparaître.
Le grand inconvénient est que la formation de nickel est également très difficile à voir.
Vérifie aussi encore une fois la polarité de l'anode, elle doit être sur le positif, tandis que l'objet à recouvrir doit être sur le négatif.
- Options de paiement
-
Vous pouvez compléter votre achat avec nous en utilisant les méthodes de paiement suivantes :
- ApplePay
- Bancontact
- Belfius
- Carte de crédit
- KBC
- Klarna
- PayPal
- Prépaiement (par virement bancaire)
Les modes de paiement disponibles peuvent varier en fonction du pays de livraison, de la technologie utilisée, des cookies sélectionnés ou du contenu du panier.
- Informations sur l'expédition
-
Vous trouverez ici le tableau des frais de livraison.
Pour les petits objets légers, l’envoi peut se faire en Petit paquet (jusqu’à 1 kg). Notez toutefois que l’option « Petit paquet » peut parfois prendre un peu plus de temps avant d’être livrée. Le délai moyen dans l’UE est généralement d’environ 3 à 7 jours.
Pays Expédition de colis Petit paquet Belgique, France, Luxembourg, Monaco 12,00€ 6,90€ Italie 12,00€ 6,90€ Suisse 17,00€ 7,90€































